
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:从下表格中判断下列说法正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
科目:高中化学 来源: 题型:单选题
常温下,用 0.01 mol·L-1NaOH溶液滴定 20.00 mL 0.01 mol·L-1 CH3COOH溶液,所得滴定曲线如图。下列说法正确的是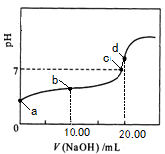
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+ c(CH3COO-) = c(Na+)+ c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s) 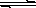 Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
| A.溶液中钙离子数目减小 | B.溶液中钙离子浓度减少 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
A.含有大量S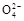 的溶液中肯定不存在Ag+ 的溶液中肯定不存在Ag+ |
| B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10
下列推断正确的是( )
| A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4) |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子中毒 |
| D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com