
| A.烧制陶罐 | B.雕刻石雕 | C. 水车灌溉 | D.预报地震 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Ca(ClO)2+2HCl═CaCl2+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
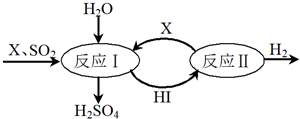
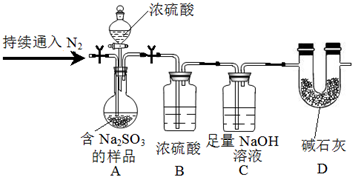
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O+$\frac{3}{2}$O2═CO2+2H2O△H=-726.51 kJ•mol-1 | |
| B. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.51 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2含有的氯原子数为0.1NA | |
| B. | 3.4 g NH3含有的分子数为0.2NA | |
| C. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| D. | 100 mL 0.1 mol/L的Na2SO4溶液中,Na+数为0.01 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com