
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
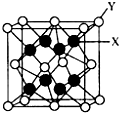 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子.| m |
| V |
 中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,
中,Y为镨原子,X为氧原子,可以看到,氧原子在晶胞的内部,故此晶胞中应有8个氧原子,| m |
| V |
| ||
| a3 |
| 4×140 |
| 6.02×1023×(516×10-10)3 |
| 4×140 |
| 6.02×1023×(516×10-10)3 |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属化学变化 |
| B、汽油、煤油、柴油和植物油都是碳氢化合物 |
| C、石油的催化裂化的主要目的是获得汽油等轻质油 |
| D、石油分馏得到的汽油是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池中Zn作负极,发生还原反应 |
| B、该电池工作时电流由Zn经导线流向MnO2 |
| C、该电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
| D、该电池工作时,若电路中转移2NA个电子(NA为阿伏加德罗常数),则负极质量减少约65g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY2 |
| B、X2Y3 |
| C、X3Y2 |
| D、X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由A、C、D三种元素组成的化合物可以是离子化合物 |
| B、F与D形成的化合物熔点高,可以与某种酸反应 |
| C、原子半径由大到小的顺序是:E>F>C>D |
| D、五种元素中最高价氧化物对应的水化物酸性最强的是D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层电子数逐渐增多 |
| B、原子半径逐渐增大 |
| C、最高正价数值逐渐增大 |
| D、从硅到氯负价从-4-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com