
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+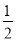 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:_____________________________________。
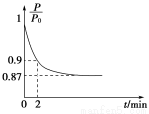
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题:
①反应达平衡的标志是__________________________(填字母代号,下同)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________________。
③欲提高N2的转化率,可采取的措施有_____________________________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol·L-1。
Ⅰ. 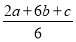
Ⅱ.(1)D CO-2e-+CO32-=2CO2
(2)①AC ②0.1 mol·L-1·min-1 ③AB (3)0.01
【解析】Ⅰ.三个热化学方程式依次编号为①、②、③,根据盖斯定律,(①×2+②×6+③)÷6得,C(s)+O2(g)=CO2(g) ΔH=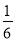 (2a+6b+c)kJ·mol-1,则C的燃烧热为
(2a+6b+c)kJ·mol-1,则C的燃烧热为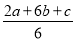 kJ·mol-1。Ⅱ.(1)自发的氧化还原反应可以设计成原电池,选D;负极失电子发生氧化反应,负极反应为CO-2e-+CO32-=2CO2。
kJ·mol-1。Ⅱ.(1)自发的氧化还原反应可以设计成原电池,选D;负极失电子发生氧化反应,负极反应为CO-2e-+CO32-=2CO2。
(2)①此反应是反应前后气体分子数不相等的反应,压强不变说明达到平衡;因为气体总的质量不变,容器体积不变,所以密度始终不变,不能运用密度不变作为反应达到平衡的标志,NH3的生成速率是N2的生成速率的2倍,说明反应达到平衡。②设反应的N2为x mol,则反应的H2为3x mol,生成的NH3为2x mol,由压强关系得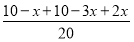 =0.9,解得x=1,则用氮气表示的平均反应速率为
=0.9,解得x=1,则用氮气表示的平均反应速率为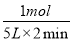 =0.1 mol·L-1·min-1。③此反应的正反应为放热反应,所以升高温度平衡逆向移动,氮气的转化率降低,C错误;充入氦气使压强增大,但各物质的浓度不变,平衡不移动,氮气的转化率不变,D错误;加入一定量的氮气,氮气的转化率降低,E错误。(3)根据题给数据,由Ksp(BaCO3)=c(Ba2+)·c(CO32-)得c(Ba2+)=4×10-8mol·L-1,混合后溶液中,c(Ba2+)=2×10-8mol·L-1,要想产生BaSO4沉淀,至少需要
=0.1 mol·L-1·min-1。③此反应的正反应为放热反应,所以升高温度平衡逆向移动,氮气的转化率降低,C错误;充入氦气使压强增大,但各物质的浓度不变,平衡不移动,氮气的转化率不变,D错误;加入一定量的氮气,氮气的转化率降低,E错误。(3)根据题给数据,由Ksp(BaCO3)=c(Ba2+)·c(CO32-)得c(Ba2+)=4×10-8mol·L-1,混合后溶液中,c(Ba2+)=2×10-8mol·L-1,要想产生BaSO4沉淀,至少需要
c(Ba2+)·c(SO42-)=Ksp(BaSO4),计算得c(SO42-)=5×10-3mol·L-1,则加入Na2SO4溶液的物质的量浓度最小是0.01 mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学指导冲关 第10练常见有机化合物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.食用白糖的主要成分是蔗糖
B.小苏打的主要成分是碳酸钠
C.煤气的主要成分是丁烷
D.植物油的主要成分是高级脂肪酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练3 元素及其化合物练习卷(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是( )
选项实验事实结论
A将SO2通入含HClO的溶液中生成H2SO4HClO酸性比H2SO4强
B铝箔在酒精灯火焰上加热熔化但不滴落铝箔表面氧化铝熔点高于铝
CSiO2可以和NaOH溶液及HF溶液反应SiO2属于两性氧化物
D将SO2通入溴水中,溴水褪色SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练3 元素及其化合物练习卷(解析版) 题型:选择题
在实验室中,下列除去杂质的方法不正确的是( )
A.溴苯中混有溴,加入碳酸钠溶液,振荡,然后分液
B.乙烷中混有乙烯,通入氢气,在一定条件下反应,使乙烯转化为乙烷
C.硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置,分液
D.乙烯中混有SO2和CO2,将其通入NaOH溶液中洗气
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练2 化学基本理论练习卷(解析版) 题型:选择题
在相同的温度下,体积均为0.25 L的两恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如表所示,下列叙述错误的是( )
| 起始时各物质的物质 的量(mol) | 达到平衡时能量变化 | ||
容器编号 | N2 | H2 | NH3 | |
① | 1 | 3 | 0 | 放出23.15 kJ能量 |
② | 0.9 | 2.7 | 0.2 | 放出Q kJ能量 |
A.容器①、②中反应的化学平衡常数相等
B.平衡时,两容器中氨气的体积分数均为14.3%
C.反应②达到平衡时,放出的热量Q=23.15 kJ
D.若①的体积为0.5 L,则达到平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:填空题
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
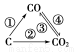
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)??CH3OH(g)
方法二 CO2(g)+3H2(g)??CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:实验题
教材中给出了Na2O2与H2O反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑。为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图所示装置进行实验。

实验步骤如下:
①按图示组装仪器,并检查装置气密性为良好后装入药品。
②保持K1打开、K2关闭,将注射器中的蒸馏水推入试管中,此时试管中并无气体产生。
③挤压装有酚酞的胶头滴管,使酚酞滴入试管中,试管中溶液显红色。
④挤压装有稀盐酸的胶头滴管,使稀盐酸滴入试管中,红色消失后再滴加2滴。
⑤用双连打气球向A中试管中鼓气,使试管中溶液通过喷头进入B中支管中,发现淀粉-KI溶液变蓝,KMnO4溶液褪色。
⑥迅速打开K2、关闭K1,继续向A中试管中鼓气,待试管中溶液进入C中试管中约三分之一时停止鼓气。然后用热水浴加热C中试管片刻,有气泡冒出,经检验为氧气。
请回答下列问题:
(1)用离子方程式表示淀粉-KI溶液变蓝的原因:_____________________________
________________________________________________________________________。
(2)用离子方程式表示KMnO4溶液褪色的原因: ______________________________
________________________________________________________________________。
(3)A中用冰盐冷浴和C中用热水浴的作用分别是________、______________________。
(4)Na2O2与H2O反应的机理是____________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是( )
已知类推
A将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓
+2H2ONaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C铁和氯气反应:2Fe+3Cl2 2FeCl3铁和碘单质反应:2Fe+3I2
2FeCl3铁和碘单质反应:2Fe+3I2 2FeI3
2FeI3
D向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HclO 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com