
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是
A.v(CO)=v(H2O)时,反应达到平衡状态
B.保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C.其他条件不变,仅将容器的体积缩小一半,反应速率加快
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是
A. 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B. 将葡萄糖溶液加入新制Cu(OH)2悬浊液至沸腾,出现红色沉淀
C. 将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫红色褪去
D. 将SO2滴入盛有酚酞的NaOH溶液中,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是
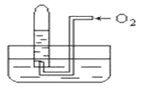
A.NO2一种气体B.O2与NO2的混和气体
C.NO与NO2的混和气体D.N2与NO2的混和气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯与浓硫酸、浓硝酸在100℃时能获得不溶于水的淡黄色针状晶体,请写出反应方程式:__________。上述反应是加成反应还是取代反应?请判断并说明原因:__________________。
(2)Mg3N2是离子化合物,各原子均满足8电子稳定结构,写出Mg3N2的电子式:__________。
(3)在常压下,乙醇在水中的溶解度比溴乙烷在水中的溶解度大,主要原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g)△H<0
①该反应中,反应物总能量_______(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为________mol。
③该反应中,还原剂为_______(填化学式),氧化产物与还原产物的质量比为_______。
(2)也可以利用甲烷催化还原氮氧化物,已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol ;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H2=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_______。
(3)锌锰干电池是应用最普遍的电池之一(如图所示),总反应方程式为: Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O
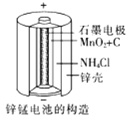
①锌锰干电池的负极材料是________,
②负极发生的电极反应方程式为:_______
③正极发生的电极反应方程式为:________。
④若反应消耗32.5 g负极材料,则电池中转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,下面表示的反应速率最快的是
A.v(A)=0.5mo1/(L·s)B.v(B)=1.8mo1/(L·min)
C.v(C)=0.9mo1/(L·s)D.v(D)=1.0mo1/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com