
【题目】干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物。完成上述反应可选用下列装置进行。

(1)当气体流向从左到石时,仪器连接的顺序是___________。
(2)装置B中试剂的作用是_________,装置C的作用是______。
(3)装置D 中反应的化学方程式是__________。
(4)装置A 中反应的化学方程式是_________ 。
(5)若实验室要收集氨气,选择E装置时,棉花的作用为_________,选择F 装置时,氨气应从______口进。

(6)工业制备氨气的化学方程式为_________。
【答案】 ACDB 吸收尾气 干燥氨气 2NH3+3CuO![]() N2+3Cu+3H2O 2NH4Cl+Ca(OH)2
N2+3Cu+3H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 防止与空气对流,使收集的氨气不纯 b N2+3H2
CaCl2+2NH3↑+2H2O 防止与空气对流,使收集的氨气不纯 b N2+3H2![]() 2NH3
2NH3
【解析】(1). 干燥的氨气在高温下能被氧化铜氧化,生成两种单质和一种化合物,单质为氮气和铜,化合物是水,根据装置图可知A为制取氨气的装置,B为尾气吸收装置,C为干燥氨气的装置,D为氨气与氧化铜反应的装置,所以仪器连接的顺序为ACDB,故答案为:ACDB;
(2). 由上述分析可知,B为尾气吸收装置,C为干燥氨气的装置,故答案为:吸收尾气;干燥氨气;
(3). 在D装置中氨气与氧化铜反应生成氮气、铜和水,根据得失电子守恒和原子守恒,该反应的化学方程式为2NH3+3CuO![]() N2+3Cu+3H2O,故答案为:2NH3+3CuO
N2+3Cu+3H2O,故答案为:2NH3+3CuO![]() N2+3Cu+3H2O;
N2+3Cu+3H2O;
(4). A为制取氨气的装置,由装置图可知,制取氨气的原料为氯化铵和氢氧化钙固体,在加热的条件下氯化铵和氢氧化钙反应生成氨气、氯化钙和水,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(5). 用E装置收集氨气时,在试管口塞一团棉花,可以防止与空气对流,使收集的氨气不纯;因氨气的密度比空气小,用F装置收集氨气时,应从b口通入氨气,空气从a口排出,故答案为:防止与空气对流,使收集的氨气不纯;b;
(6). 工业上通常采用氮气和氢气在高温、高压及催化剂的作用下制备氨气,化学方程式为N2+3H2![]() 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2![]() 2NH3。
2NH3。


科目:高中化学 来源: 题型:
【题目】在制取蒸馏水的蒸馏实验中,下列叙述不正确的是
A. 在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石
B. 将温度计水银球插入自来水中
C. 冷水从冷凝管下口入,上口出
D. 若开始加热后发现忘记放入沸石,应待溶液冷却后,重新加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)n(SO4)3﹣n/2]m是一种新型高效的水处理混凝剂,某课题小组设计如下方案制备聚合硫酸铁,其简单工艺流程如图1:
为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2 , 调节pH<3,加热煮沸;加入过量KI充分反应后,再用0.1 000molL﹣1 Na2S2O3标准溶液滴定至终点,消耗标准溶液VXmL.已知:I2+2S2O32﹣═I﹣+S4O62﹣ . .
(1)实验过程中加热煮沸的目的是 .
(2)在测定过程中加入足量H2O2发生反应离子方程式: .
(3)滴定过程中选择装标准溶液仪器(如图2)是否合理(填“是”或“否”)
(4)写出滴定选用的指示剂 , 滴定终点观察到的现象 .
(5)根据图1消耗的Na2S2O3标准溶液体积,计算出溶液Ⅰ中铁元素的总含量为gL﹣1 . 若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会(填“偏高”“偏低”或“不变”).
(6)上述流程中溶液Ⅰ中铁元素存在不同的离子,根据题意完成下面假设并设计实验方案证明假设假设1:溶液Ⅰ中只存在Fe2+ 假设2:溶液Ⅰ中只存在Fe3+ 假设3: .
根据提供试剂和实验用品验证假设3成立
限选实验试剂:1.0molL﹣1 NaOH溶液、8.0molL﹣1 NaOH溶液、0.01molL﹣1KMnO4、淀粉﹣KI溶液、3moLL﹣1H2SO4、紫色石蕊试液、0.1molL﹣1 K3[Fe(CN)6]溶液、试管、胶头滴管
实验步骤 | 预期现象和结论 |
步骤1:取少量溶液Ⅰ于试管A、B中 | |
步骤2: | |
步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D为应用最广泛的金属,且D与甲的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
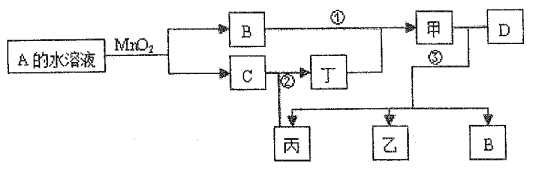
注:转化关系中,②表示C与丙反应生成丁。
(I)反应中MnO2的作用为_____,有1molA完全反应生成B、C转移____mol电子;
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:
(1)反应②的化学方程式:_______________。
(2)写出过量D与甲的稀溶液反应的离子方程式:____________。
(III)若丙为无色有刺激性气味的气体,可以使品红溶液褪色,回答(3)、(4)小题:
(3)写出下列化学方程式②:__________________;③(甲足量):_________________。
(4)检验乙溶液中离子的实验方法为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 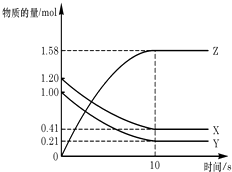
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若3.01×1023个气体分子在某状况下的体积为22.4L,则该状况下的气体摩尔体积为
A. 11.2L/mol B. 22.4L/mol C. 44.8L/mol D. 67.2L/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com