
| A. | 锌锰干电池中石墨棒作负极 | |
| B. | 氢氧燃料电池工作时,氢气在负极发生还原反应 | |
| C. | 铅蓄电池放电时,两极质量均增加 | |
| D. | 燃料电池的能量转化率可达100% |
分析 A、锌是活泼金属作负极,石墨棒作正极;
B、氢气在负极发生氧化反应;
C、根据铅蓄电池中的电极反应分析;
D、燃料电池中还有部分化学能转化为热能.
解答 解:A、锌是活泼金属作负极,石墨棒作正极,故A错误;
B、氢氧燃料电池工作时,氢气在负极发生氧化反应,故B错误;
C、放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,两极均生成难溶性的PbSO4,所以两极质量均增加,故C正确;
D、燃料电池中还有部分化学能转化为热能,所以能量转化率不是100%,故D错误;
故选C.
点评 本题考查了原电池原理,明确原电池概念内涵即可解答,知道原电池特点及能量转化方式,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 浓度 反应条件 时间(s) | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360℃ | 480℃ | t℃ | 720℃ |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所 需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L氯气含有的分之数为0.5NA | |
| B. | 常温常压下,1mol氮气含有的质子数为7NA | |
| C. | 在标准状态下,22.4LH2O含有的原子数目为3NA | |
| D. | 32gO2所含原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
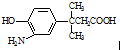 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com