
分析 (1)Cu、Al和稀硫酸构成的原电池中,Al易失电子作负极,Cu作正极,正极上氢离子得电子发生还原反应;
(2)Cu、Al和浓硝酸构成的原电池中,铝发生钝化现象,Cu易失电子作负极、Al作正极,正极上硝酸根离子得电子发生还原反应.
解答 解:(1)Cu、Al和稀硫酸构成的原电池中,Al易失电子作负极,Cu作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:铝片;2H++2e-=H2↑;
(2)Cu、Al和浓硝酸构成的原电池中,铝发生钝化现象,Cu易失电子作负极、Al作正极,正极上硝酸根离子得电子发生还原反应,电极反应式为,故答案为:铜片;NO3-+e-+2H+=NO2↑+H2O.
点评 本题考查电极反应式的书写及正负极判断,为高频考点,不能根据金属的活泼性强弱判断正负极,要根据该原电池中金属失电子难易程度判断正负极,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
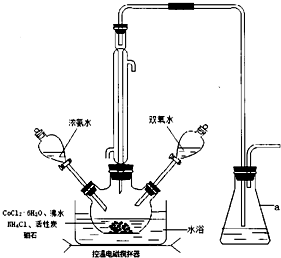
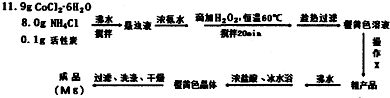
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑦ | B. | ①③④⑥⑦ | C. | ①④⑥⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
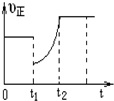 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
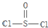 )是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:K+、ClO-、CH3CHO、SO42- | |
| B. | c(H+)=10-12mol•L-1的溶液中:Na+、NH4+、Cl-、Br- | |
| C. | 加人KSCN显血红色的溶液中:Br-、NO3-、SO42-、Mg2+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将铁加到硫酸铜溶液中 Fe+Cu2+=Fe2++Cu | 将钾加到硫酸铜溶液中 2K+Cu2+=2K++Cu |
| B | 向Ca(ClO)2溶液中通入CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 将少量碳酸钙粉末投入到足量的盐酸中 CaCO3+2H+=Ca2++CO2↑+H2O | 将少量碳酸钙粉末投入到足量的硝酸溶液中 CaCO3+2H+=Ca2++CO2↑+H2O |
| D | SO2气体通入BaCl2溶液中,不反应,因为H2SO3的酸性弱于盐酸 | SO2气体通入Ba(NO3)2溶液中也不反应,因为H2SO3的酸性弱于硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com