
| A. | 明矾净化水 | B. | 纯碱去油污 | C. | 食醋除水垢 | D. | 漂白粉漂白织物 |
分析 用到的物质的氧化性,说明该过程中发生了氧化还原反应,而且该物质在反应中得电子化合价降低而作氧化剂,根据元素化合价变化来判断.
解答 解:A.明矾中含有铝离子,铝离子水解生成氢氧化铝胶体,胶体具有吸附性而净水,该过程中没有元素化合价变化,所以为非氧化还原反应,故A错误;
B.纯碱为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,油污和碱发生水解反应,该过程中没有元素化合价变化,所以为非氧化还原反应,故B错误;
C.碳酸钙和醋酸反应生成醋酸钙、二氧化碳和水,该过程中没有元素化合价变化,所以为非氧化还原反应,故C错误;
D.漂白粉具有强氧化性,利用其强氧化性漂白织物,故D正确;
故选D.
点评 本题考查了氧化还原反应,明确物质的性质以化合价的变化是解本题关键,性质决定用途,用途体现性质,难度不大.


科目:高中化学 来源: 题型:解答题
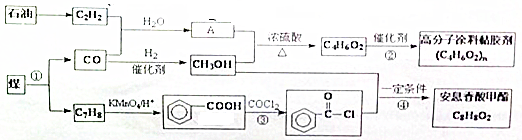
 .已知反应④为取代反应,写出该反应的化学方程式CH3OH+
.已知反应④为取代反应,写出该反应的化学方程式CH3OH+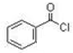 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +HCl.
+HCl.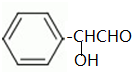 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH>7 | |
| C. | 物质的量浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| D. | 能使石蕊试液变红的溶液中,Fe2+、Na+、NO3-、Cl-能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用磨口玻璃瓶保存NaOH溶液 | ||
| C. | 稀硝酸可除去试管内壁的银镜 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
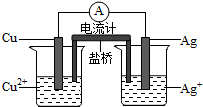 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
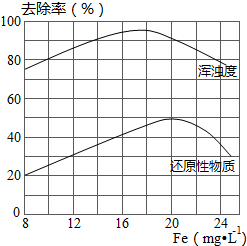 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 转化 | 解释 | |
| A | CuS+H2SO4=CuSO4+H2S↑ | 酸性:H2SO4>H2S |
| B | AgCl(s)+I-(aq)?AgI(s)+Cl-(aq) | Kap(AgCl)<Kap(AgI) |
| C | 2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Fe+S$\frac{\underline{\;加热\;}}{\;}$FeS | 氧化性:Cl2>S |
| D | C(s,石墨)=C(s,金刚石)△H=+1.9kL/mol | 稳定性:石墨<金刚石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com