
分析 (1)H++OH-═H2O表示强酸和强碱的酸碱中和反应;
(2)Al2(SO4)3是强电解质,在溶液中完全电离;先计算硫酸铝的物质的量,根据化学式中硫酸铝和硫酸根离子的关系式计算硫酸根离子的个数,根据物质的量浓度公式计算硫酸根离子的物质的量浓度.
(3)少量二氧化碳和氢氧化钡反应生成碳酸钡和水;
(4)根据氧化还原反应中化合价升高的是还原剂,降低的是氧化剂,根据发生化合价变化的量判断还原剂与氧化剂的关系,及转移电子数,根据化学方程式书写离子方程式.
解答 解:(1)H++OH-═H2O表示强酸和强碱的酸碱中和反应,且酸碱反应中只有水生成,强酸是硝酸,强碱是氢氧化钡,反应方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(2)少量二氧化碳和氢氧化钡反应生成碳酸钡和水,离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O;
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(3)Al2(SO4)3是强电解质,在溶液中完全电离,其电离方程式为:Al2(SO4)3═2Al3++3SO42-;17.1gAl2(SO4)3的物质的量是$\frac{17.1g}{342g/mol}$=0.05mol,所以硫酸根离子的个数=0.05mol×3NA=0.15NA;
C=$\frac{0.05mol×3}{0.25L}$=0.6mol/L.
故答案为:Al2(SO4)3═2Al3++3SO42-;0.15NA;0.6mol/L.
(4)已知Al+4HNO3=Al(NO3)3+NO↑+2H2O,HNO3→NO,氮元素化合价从+5降低为+2,HNO3是氧化剂;1molAl从0价升高为+3价,失去3mol电子,
1molHNO3化合价从+5降低为+2得到3mol电子,所以还原剂与氧化剂的物质的量相等;n(Al)=$\frac{m}{M}$=$\frac{5.4g}{27g/mol}$=0.2mol,所以转移电子的物质的量为0.2mol×3=0.6mol;Al和4HNO3反应的离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O,
故答案为:HNO3;1:1;0.6mol;Al+4H++NO3-=Al3++NO↑+2H2O.
点评 本题是一道关于离子反应、物质的量的计算以及物质的性质方面知识的综合考查题,要求学生具有分析和解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶解性(本身均可做溶剂) | 沸点(℃) | 密度(g/mL) | |
| 乙醇 | 与水混溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
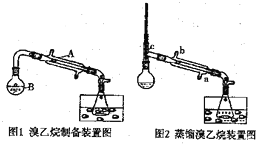
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的化合物一定不是离子化合物 | |
| B. | 含有金属元素的化合物一定是离子化合物 | |
| C. | 活泼金属与活泼非金属化合时,能形成离子键 | |
| D. | 第IA族和VIIA族原子化合时,一定生成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$ mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中 O2 和CH4 体积比为2:1 | |
| B. | 原混合气体中 O2 和CH4 体积比为1:1 | |
| C. | 残留固体中只有Na2CO3 | |
| D. | 残留固体中只有Na2CO3 和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1.
,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1. 、
、 、
、 (一种即可)
(一种即可) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com