

| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品中Fe元素的质量为2.24 g | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
分析 硫酸足量,由氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,以此来解答.
解答 解:硫酸足量,由于氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,
A.生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有+3价铁离子,则溶液A中含Fe2+、H+,故A错误;
B.Fe的物质的量为$\frac{3.2g}{160g/mol}$×2=0.04mol,其质量为:0.04mol×56g/mol=2.24g,故B正确;
C.根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故C错误;
D.最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量:$\frac{5.76g-3.2g-2.24g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448mL,故D错误.
故选B.
点评 本题考查金属及化合物的性质、混合物分离提纯综合应用等,为高频考点,题目难度中等,把握物质的性质及氧化还原反应等为解答的关键,侧重分析与应用能力的考查.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中只有一种阴离子(OH-除外) | B. | 溶液中溶质的物质的量之比为1:2 | ||
| C. | 反应后有CO2逸出 | D. | 反应后的溶液还可以吸收部分CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 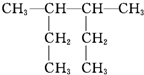 3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 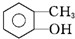 邻甲基苯酚 邻甲基苯酚 | |
| D. | 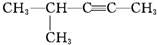 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
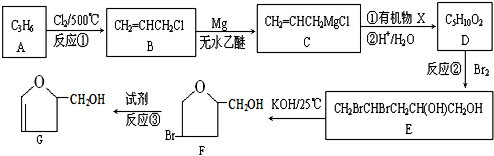

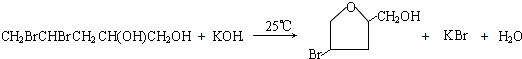 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内X、Y、Z浓度之比为1:2:2 | |
| D. | 混合气的平均摩尔质量不随时间变化时 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
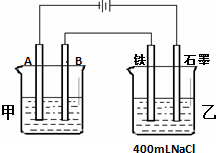 如图所示为相互串联的甲、乙两个电解池,试回答:
如图所示为相互串联的甲、乙两个电解池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有含氢元素的化合物中都存在氢键,氢键比范德华力强 | |
| B. | H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 | |
| C. | 氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 | |
| D. | 分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸锶难溶于水 | B. | 氢氧化锶的碱性比氢氧化钙弱 | ||
| C. | 单质锶跟冷水不反应 | D. | 锶是第四周期元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com