
 xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵����ȷ���� (����)
xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ������˵����ȷ���� (����)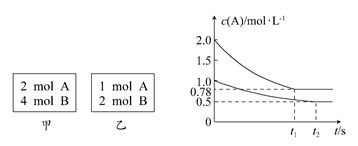
 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �������������� n/mol T/�� | ����̿ | NO | E | F |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | X | Y | Z |
| ��ʼ���ʵ���(mol) | 0.2 | 0.2 | 0 |
| ƽ�����ʵ���(mol) | 0.1 | 0.05 | 0.1 |
 2Z����ƽ�ⳣ��Ϊ8 000
2Z����ƽ�ⳣ��Ϊ8 000�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g) ��H=" -92.6kJ/mol." ����������±�
2NH3(g) ��H=" -92.6kJ/mol." ����������±�| ������� | ��ʼʱ���������ʵ���/mol | �ﵽƽ��ʱ��ϵ�����ı仯 | ||
| N2 | H2 | NH3 | ||
| ��1�� | 2 | 3 | 0 | 27.78kJ |
| ��2�� | 1.6 | 1.8 | 0.8 | Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
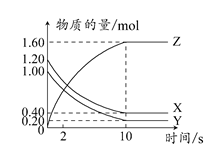
| A��ƽ��ʱ��X��Y��ת������ͬ |
| B���ﵽƽ����������ѹ��Ϊ1 L��ƽ��������Ӧ�����ƶ� |
C��T��Cʱ���÷�Ӧ�Ļ�ѧ����ʽΪ��X(g)��Y(g) 2Z(g)��ƽ�ⳣ��K��40 2Z(g)��ƽ�ⳣ��K��40 |
| D��T��Cʱ������ʼʱXΪ0.71 mol��YΪ1.00 mol����ƽ��ʱY��ת����ԼΪ60% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bZ(g)
bZ(g)| A��a��1��b��1 | B��a��2��b��1 |
| C��a��2��b��2 | D��a��3��b��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)����H<0��4 s��Ӧ�ﵽƽ��״̬����ʱ���C��Ũ��Ϊ0.6 mol/L������˵����ȷ����(����)
2C(g)����H<0��4 s��Ӧ�ﵽƽ��״̬����ʱ���C��Ũ��Ϊ0.6 mol/L������˵����ȷ����(����)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)��D(s)������˵����ȷ����(����)
2C(g)��D(s)������˵����ȷ����(����)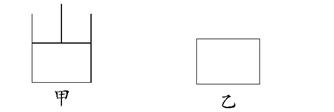
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��һ�������£�2molsO2������O2��Ӧ�ɵõ�2molsO3 |
| B����4mol HCl��Ũ������������MnO2���ȷ�Ӧ���Ʊ�1mol Cl2 |
| C��10mL 18.0mol/L H2SO4������ͭ���ȷ�Ӧ���Ʊ�0.09molsO2 |
| D��һ�������£�1mol N2��3mol H2��Ӧ���Ʊ�1.0mol NH3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com