
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
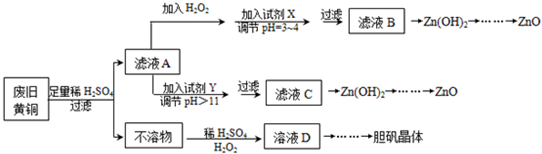
分析 由实验流程可知,Zn、Fe与硫酸反应,可知不溶物为Cu,Cu与过氧化氢、硫酸反应生成硫酸铜溶液,则D为硫酸铜溶液,蒸发浓缩、冷却结晶得到胆矾;滤液A中含硫酸亚铁、硫酸锌、硫酸,加过氧化氢可将亚铁离子氧化,条件pH使铁离子转化为沉淀,可利用ZnO、Zn(OH)2等促进铁离子水解转化为沉淀,滤液B主要含硫酸锌,与碱反应生成氢氧化锌,再加热分解生成ZnO;A中加Y调节pH值大于11,故可以加入强碱,Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,再加热分解生成ZnO.
(1)酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子;
(2)调节溶液pH,降低溶液酸度,可以使铁离子全部沉淀,从而除去;
(3)此过程需要调节pH值大于11,故可以加入强碱;pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解;
(4)酸性条件下Cu与过氧化氢发生氧化还原反应生成硫酸铜和水;
(5)依据从溶液中得到固体需要蒸发浓缩、冷却结晶以及抽滤等回答;
(6)①根据相关反应的方程式,可得到关系式2Na2S2O3 ~2Cu2+,根据反应的关系式计算;
②滴定前仰视、滴定后俯视滴定管读数,△V偏小.
解答 解:(1)酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子,离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)调节溶液pH,降低溶液酸度,可以使铁离子全部沉淀,加ZnO、Zn(OH)2等促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去,调节pH=3~4的目的是使Fe3+转化为Fe(OH)3,达到除去Fe3+的目的,
故答案为:AC;使Fe3+转化为Fe(OH)3,达到除去Fe3+的目的;
(3)此过程需要调节pH值大于11,故可以加入强碱:NaOH,由于pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-,类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解,故答案为:B;
(4)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(5)从溶液中得到固体需要蒸发浓缩、冷却结晶以及抽滤等操作,故答案为:蒸发浓缩、冷却结晶;
(6)①CuCl2溶液与KI反应的离子方程式为:2Cu2++4I-═2CuI↓+I2,且发生I2+2S2O32-═2I-+S4O62-,则可得关系式2Na2S2O3 ~2Cu2+,
则n(CuSO4•5H2O)=n(Na2S2O3)=0.100mol/L×19.60×10-3L=1.96×10-3mol,
m(CuSO4•5H2O)=1.96×10-3mol×250g/mol=0.490g,
ω(CuSO4•5H2O)=$\frac{0.490g}{0.5000g}$×100%=98.00%,故答案为:98.00%;
②若滴定前仰视、滴定后俯视滴定管读数,从而消耗Na2S2O3标准溶液体积偏小,故测量纯度偏低,故答案为:偏低.
点评 本题考查制备实验方案的设计,为高频考点,考查学生对综合实验处理能力,注意实验方案的设计原理和步骤是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
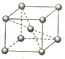 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.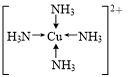 (写在方框内).
(写在方框内).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 浓硫酸具有吸水性,可做干燥剂,但不能干燥NH3 | |
| C. | 钠保存在煤油中,若长期放置在空气中,最终变为NaHCO3 | |
| D. | 镁着火后可以用CO2来灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com