
【化学——选修2:化学与技术】(15分)海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用 (写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。

(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
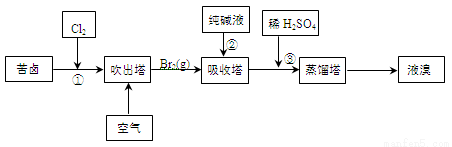
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
(1)①结晶;(2分) ②阻止氢气与氯气反应,或阻止氯气与氢氧化钠反应使烧碱不纯;(2分)
(2)①海水中含有较多的镁离子和钙离子,会产生氢氧化物沉淀从而堵塞阳离子交换膜。(3分)
②淡水;(2分) (3)①3CO32-+3Br2=5Br-+BrO3-+3CO2↑;(2分) ②富集溴;(2分)
③顺利将溴蒸出,同时防止水馏出。(2分
【解析】
试题分析:(1)①海水晒盐需要通过蒸发、结晶过程,因此所建盐田分为贮水池、蒸发池和结晶池。
②在氯碱工业中由于阳离子交换膜只能允许阳离子通过,而阴离子和气体均不能通过。因此用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极。相反如果氯气进入阴极易和氢气混合产生爆炸,同时也容易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯。
(2)①由于海水中含有较多的镁离子和钙离子,电解时阴极产生的氢氧根离子会和金属阳离子结合生成氢氧化物沉淀从而堵塞阳离子交换膜,导致电渗析法失败,所以海水不能直接通入到阴极室中。
②根据电渗析法淡化海水示意图可知,阴离子移向阳极,阳离子移向阴极,导致①室离子浓度变小,②室离子浓度不大,离子浓度大的为浓水,所以淡水在A处排出;
(3)①若吸收塔中的溶液含BrO3-,这说明碳酸钠与溴水反应,则吸收塔中反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑;
②由于从①出来的溶液中单质溴的含量不高,如果直接蒸馏,造成产品成本高,所以需要进一步浓缩溴,以提高溴的浓度;
③如果温度过高,超过100℃,则水蒸气也会被蒸出,导致溴中含有水分;如果温度过低溴又不能能完全蒸出,导致产率低,所以向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏。
考点:考查海水综合应用的有关分析与判断


科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
下列判断错误的是
A.酸性:HClO4>H2SO4>H3PO4 B.沸点:NH3>PH3>AsH3
C.熔点:Si3N4>NaCl>SiI4 D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是
A.Cl2通入FeSO4溶液中
B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中
D.SO2通入BaCl2溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:选择题
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。下列选项中不正确的是

A.Mg与F2反应的△S<0
B.MgF2(s)+Br2(l)==MgBr2(s)+F2(g)△H=+600kJ·mol-1
C.MgBr2与Cl2反应的△H<0
D.化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:选择题
下列实验操作与安全事故处理错误的是
A.用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热
B.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
D.实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:填空题
(12分)二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。

(1)B必须放在冰水浴中控制温度,其原因是
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

①Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
②Ⅱ中反应的离子方程式是 。
③A的化学式是 ,装置Ⅲ中A在 极区产生。
④ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
⑤NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法中正确的是
①46g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥0.lmol·L-1Na2CO3溶液中含有0.1NA个CO32-
⑦1 mol Na2O2与水完全反应时转移电子数为2NA
A.③⑥⑦ B.①②⑤ C.①②④ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列图示的四种实验操作是常用的分离提纯的方法,其名称从左到右依次是

A.蒸发、蒸馏、过滤、萃取 B.过滤、蒸馏、蒸发、萃取
C.过滤、蒸发、蒸馏、分液 D.萃取、蒸馏、蒸发、过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com