
| A、往CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| B、向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| C、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=A1O2-+4NH4++2H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
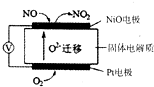 NO2是汽车尾气中的主要污染物之一.
NO2是汽车尾气中的主要污染物之一.
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g氧-18气体的物质的量是0.1mol |
| B、0.1mol重氧气体的体积是2.24L |
| C、重氧气体的摩尔质量为36g |
| D、0.1mol重氧水所含中子数约是6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S8转化为S6、S4、S2属于物理变化 |
| B、不论哪种硫分子,完全燃烧时都生成SO2 |
| C、S8、S6、S4、S2均属于共价化合物 |
| D、把硫单质在空气中加热到750℃即得S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物理性质 | 易溶于水,不溶于乙醇;熔点 48.2℃;在潮湿的空气中易潮解 |
| 化学性质 | 43℃以上的空气中易风化;遇酸易分解 (S2O32-+2H+=S↓+SO2↑+H2O ) |
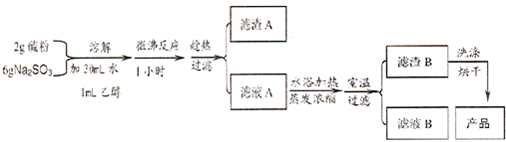
查看答案和解析>>
科目:高中化学 来源: 题型:
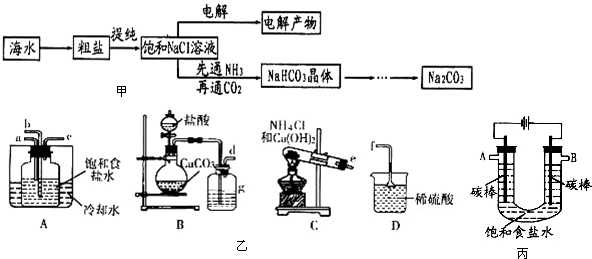
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com