
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)=C(金刚石)△H=+1.90kJ?mol-1 可知,金刚石比石墨稳定 |
| C、一定条件下,将0 5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H═-38.6kJ?mol-1 |
| D、在稀溶液中,H+(aq)+OH-(aq)═H2O(Ⅰ)△H=-57.3kJ?mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |


科目:高中化学 来源: 题型:
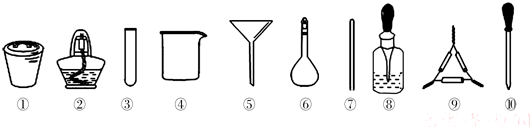
| A、第一步需选用仪器①、②和⑨,①的名称叫钳埚 |
| B、第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C、要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 |
| D、第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤⑥ | B、①③④⑤ |
| C、①②④⑥ | D、③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3溶液中NH4+和NO3-的数目 |
| B、纯水在80℃和25℃时的pH |
| C、pH与体积都相同的氨水和NaOH溶液分别用0.1 mol?L-1盐酸恰好中和,所需的盐酸体积 |
| D、相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、厨房中用的食盐、食醋都是电解质 |
| B、大量燃烧化石燃料是造成雾霾天气的重要原因 |
| C、盐类都可做调味品 |
| D、浓硫酸可以用来雕刻玻璃制工艺品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将KI和FeCl3溶液棍合,溶液变棕黄色,说明还原性Fe2+>I- |
| B、NO2通入FeSO4溶液中的过程中由浅绿色变为黄色 |
| C、能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| D、SO2通入BaCl2溶液中先有白色沉淀后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的最高价氧化物对应水化物的酸性比W的弱 |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) |
| D、Y的气态简单氢化物的热稳定性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3↑+H2O |
| C、甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应:CH3OH+H2O+6e-═CO2↑+6H+ |
| D、酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com