
【题目】用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L 稀硫酸。
(1)所需浓硫酸的体积是__________。
(2)配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、________、_________。
(3)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为 ______(填序号)。
(4)第⑦步实验的操作是__________________。
(5)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.“偏大” b.“偏小” c.“无影响”)
A.所用的浓硫酸长时间放置在密封不好的容器中_______;
B.容量瓶用蒸馏洗涤后残留有少量的水_________;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线_________;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸_______________。
【答案】2.7 mL 500 mL容量瓶 胶头滴管 ②①③⑧⑤⑥⑨⑦④⑩ 定容,沿玻璃棒往容量瓶中加蒸馏水至刻度线1~2cm处,改用胶头滴管滴至凹液面与刻度线相切 b c b a
【解析】
(1)用密度为1.84 g/mL,质量分数为98%的浓硫酸配制480 mL 0.1 mol/L稀硫酸,浓硫酸的浓度是![]() =18.4mol/L,由于需要使用500mL容量瓶,则根据稀释过程中溶质的物质的量不变可知所需浓硫酸的体积是
=18.4mol/L,由于需要使用500mL容量瓶,则根据稀释过程中溶质的物质的量不变可知所需浓硫酸的体积是![]() 。
。
(2)配制的一般步骤是计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,因此配制过程需要的玻璃仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管。
(3)根据(2)中分析可知其正确的操作顺序为②①③⑧⑤⑥⑨⑦④⑩。
(4)第⑦步是定容,其实验的操作是沿玻璃棒往容量瓶中加蒸馏水至刻度线1~2cm处,改用胶头滴管滴至凹液面与刻度线相切。
(5)A.所用的浓硫酸长时间放置在密封不好的容器中会导致浓硫酸吸水,浓度减小,量取的浓硫酸中溶质减少,浓度偏小,答案选b;
B.容量瓶用蒸馏洗涤后残留有少量的水不会影响溶质的质量和溶液体积,浓度不变,答案选c;
C.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,溶液体积增加,浓度偏小,答案选b;
D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸,硫酸的体积增加,溶质的质量增加,浓度偏大,答案选a。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表给出的几种物质的熔点、沸点数据判断说法中错误的是 ( )

A. SiCl4是分子晶体 B. MgCl2中键的强度比NaCl中键的强度小
C. 单质R是原子晶体 D. AlCl3为离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
COS(g)+H2(g) K=1。反应前CO物质的量为1mol,平衡后CO物质的量为0.5mol。下列说法正确的是( )
A. 羰基硫的电子式为: :![]() :
:![]() :
:![]() :
:
B. 通入CO后,正反应速率逐渐增大
C. 再加入0.1molH2S和0.1molH2,平衡不移动
D. 反应前H2S物质的量为0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是
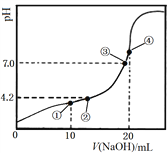
A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是
A.电子流从铁棒经导线流入铜棒B.溶液逐步变为浅绿色
C.溶液的酸性减弱D.气泡在铁片上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:

(1)写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。
(2)恒压滴液漏斗的作用是________。
(3)有同学建议该CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种): ________ 。

(4)反应器C中发生反应的化学方程式为________ 。
(5) 双通玻璃管的作用________;b中溶液的作用________ 。
(6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1: 取少量固体样品于试管中,加入蒸馏水至固体溶解。
得到无色溶液
步骤2: 向试管中加入过量的BaCl2溶液,静置。
溶液不变浑浊,则证明固体中不含有________。
步骤3: 取步骤2的上层清液于试管中加入少量 的______。
溶液变浑浊,则证明固体中含有_______。
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com