
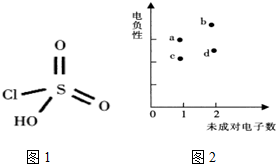
 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1. ;已知过氧硫酸的结构式为
;已知过氧硫酸的结构式为 ,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为
,S原子形成4对成键电子对,所以中心硫原子的轨道杂化类型为sp3;已知过氧硫酸的结构式为 ,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价;
,O与S之间形成6对共用电子对,S的吸引电子能力比O弱,电子对偏离S,所以S为+6价; ;sp3;+6.
;sp3;+6.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、O、F、H的原子半径依次减小 |
| B、HI、HBr、HCl、HF的沸点依次降低 |
| C、干冰、钠、冰的熔点依次降低 |
| D、金属Na、Mg、Al的硬度依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42- | ||
| B、常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3- | ||
C、常温下,
| ||
| D、与Al反应产生H2的溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比软铁心(几乎是纯铁)容易生锈 |
| C、铁制器件附有铜质配件,在接触处易生锈 |
| D、铁丝在纯氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28g氮气所含有的原子数目为NA |
| B、1molNa被完全氧化生成Na2O2,失去电子数目为NA |
| C、标准状况下,22.4L水中含有NA个水分子 |
| D、1mol/L的CaCl2溶液中含有的Cl-数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.
A、B、C、D、E是原子序数依次增大的五种元素.B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=
Ⅰ、(将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 平衡移动的因素 | 平衡移动的方向(填“逆反应方向”或“正反应方向”) |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com