
【题目】下列物质与水反应生成强酸的是( )
A.Na2O
B.SO3
C.CO2
D.NO
科目:高中化学 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是较早使用的一种解热镇痛药,可由苯胺和乙酸反应制备:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________ 、起着沸石的作用。
(2)步骤2中控制温度计示数约105 ℃,接引管流出的主要物质是________________,若温度过高,会导致________________。刺形分馏柱中,由下到上,温度逐渐________________(填“升高”、“降低”或“不变”)。
(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、________________(填仪器名称)。
(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)![]() 3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A. 用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B. 2 min时A、B、C三种气体的总量为5mol
C. 2 min时B的转化率为20%
D. 若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
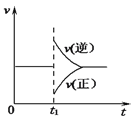
A. 维持温度、反应体系体积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度不变,t1时扩大反应体系体积
D. 维持温度、容器体积不变,t1时充入SO3(g),同时减少SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
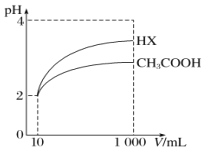
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com