
【题目】用“双线桥”标出电子转移的方向和数目,并分别指出 氧化剂和氧化产物。
(1)Fe+CuSO4=FeSO4+Cu ________ 氧化剂是 ____________氧化产物是_____________,
(2)3CO+Fe2O3![]() 3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
【答案】 CuSO4 FeSO4
CuSO4 FeSO4 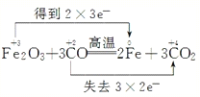 Fe2O3 CO2
Fe2O3 CO2
【解析】
根据氧化还原反应中得失电子守恒进行配平,并分析氧化剂、还原剂、氧化产物、还原产物。
(1)反应方程式Fe+CuSO4=FeSO4+Cu中化合价变化为:Fe→FeSO4,Fe元素由0价→+2价,一个Fe原子失2个电子,所以Fe是还原剂,FeSO4是氧化产物;CuSO4→Cu,Cu元素由+2价→0价,一个CuSO4得2个电子,所以CuSO4是氧化剂,Cu是还原产物;其得失电子的最小公倍数是2,所以其转移电子数为2,用“双线桥”标出电子转移的方向和数目为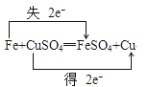 ;氧化剂为CuSO4;氧化产物为FeSO4;
;氧化剂为CuSO4;氧化产物为FeSO4;
(2)反应方程式3CO+Fe2O3![]() 3CO2+2Fe中化合价变化为:CO→CO2,C元素由+2价→+4价,一个CO分子失2个电子,所以CO是还原剂,CO2是氧化产物;Fe2O3→Fe,Fe元素由+3价→0价,一个Fe2O3得6个电子,所以Fe2O3是氧化剂,Fe是还原产物;其得失电子的最小公倍数是6,所以其转移电子数为6,用“双线桥”标出电子转移的方向和数目为
3CO2+2Fe中化合价变化为:CO→CO2,C元素由+2价→+4价,一个CO分子失2个电子,所以CO是还原剂,CO2是氧化产物;Fe2O3→Fe,Fe元素由+3价→0价,一个Fe2O3得6个电子,所以Fe2O3是氧化剂,Fe是还原产物;其得失电子的最小公倍数是6,所以其转移电子数为6,用“双线桥”标出电子转移的方向和数目为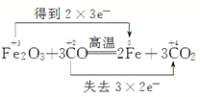 ;氧化剂为Fe2O3;氧化产物为CO2。
;氧化剂为Fe2O3;氧化产物为CO2。


科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,
是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,![]() 、
、![]() 、
、![]() 、
、![]() 分别是由
分别是由![]() 、
、![]() 、
、![]() 形成的二元化合物,且
形成的二元化合物,且![]() 与
与![]() 分子中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )。
分子中均含有10个电子。它们之间转化关系如图所示。下列说法正确的是( )。
A.原子半径:![]()
B.![]() 与
与![]() 形成的化合物只含极性键
形成的化合物只含极性键
C.![]() 有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D.稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中![]() 键、
键、![]() 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO![]() 的立体构型为________。
的立体构型为________。

(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得![]() 溶液的
溶液的![]() ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液![]() 变化如图所示:
变化如图所示:
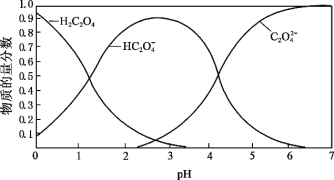
i.向草酸溶液中滴加![]() 溶液至
溶液至![]() 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入![]() ,调节
,调节![]() 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中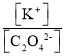 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:![]()
该反应的平衡常数表达式![]() _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:![]()
i.一定条件下,测得上述反应中溶液中![]() 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以![]() 浓度的变化表示此反应
浓度的变化表示此反应![]() 内的平均反应速率为____________
内的平均反应速率为____________![]()
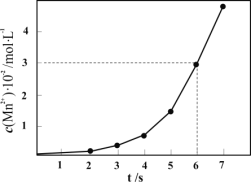
ii.分析![]() 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取![]() 的高锰酸钾产品,配成
的高锰酸钾产品,配成![]() 溶液,取出
溶液,取出![]() ,消耗
,消耗![]() 草酸标准溶液
草酸标准溶液![]() ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
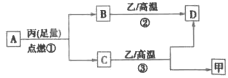
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
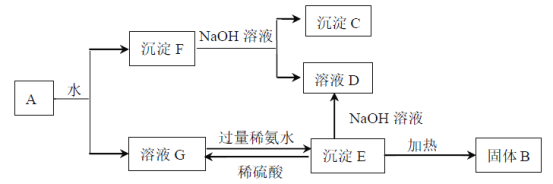
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
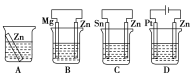
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
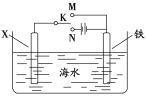
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
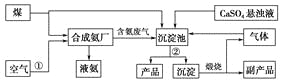
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() ,
,![]() ,
,![]() 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为![]()
![]() 。
。
根据上述数据能否计算![]() ________(填“能”或“否”),理由是________________。
________(填“能”或“否”),理由是________________。
(2)在某密闭容器中通入![]()
![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:
![]()
![]()
测得平衡时![]() 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
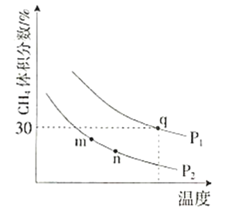
①![]() ________
________![]() ,
,![]() ________(填“<”、“>”或“=”)。
________(填“<”、“>”或“=”)。
②m、n、q三点的化学平衡常数大小关系为________。
③q点甲烷的转化率为________,该条件下的化学平衡常数![]() ________(用含有
________(用含有![]() 的表达式表示,
的表达式表示,![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
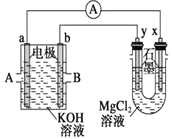
(3)用甲烷和![]() 构成的燃料电池电解
构成的燃料电池电解![]() 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
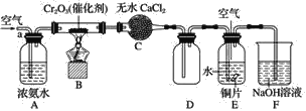
(1)B中发生反应的化学方程式是______________________________。
(2)证明氨气发生催化氧化的现象是________________,反应的方程式是________________。
(3)E中铜发生反应的离子方程式是________________________________。
(4)E中缓缓通入空气的目的是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com