
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 水结冰体积膨胀、密度变小,这一事实与水分子间存在氢键有关 | |
| C. | 分子晶体中必含化学键 | |
| D. | 干冰升华破坏了共价键 |
分析 A、根据结构判断晶体类型;
B、根据氢键对物质物理性质的影响分析;
C、稀有气体固态时为分子晶体,没有化学键;
D、化学反应的实质是旧化学键的断裂和新化学键的形成,干冰气化是物理变化,不破坏化学键,破坏分子间作用力.
解答 解:A、C60是分子晶体,金刚石属于原子晶体,故A错误;
B、氢键具有方向性,氢键的存在迫在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大.当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的间隙减小,密度反而增大,故B正确;
C、稀有气体固态时为分子晶体,没有化学键,故C错误;
D、干冰是二氧化碳的固态,属于分子晶体,气化时破坏分子间作用力,故D错误;
故选B.
点评 本题考查了化学键、氢键对物质性质的影响等知识点,难度不大,注意分子晶体不一定含有化学键.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
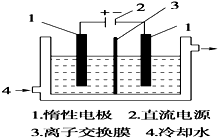 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,HAt极不稳定 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| B. | 常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(SO42-) | |
| C. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| D. | 将10 mL 0.1 mol/L Na2SO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(HSO3-)>c(SO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com