
| A. | ⅠA元素的电负性从上到下逐渐减小,而ⅦA元素的电负性从上到下逐渐增大 | |
| B. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| C. | 碳原子由1s22s22p2转化成1s22s12p3,这一过程中释放能量 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
分析 A.IA族元素从上到下金属性增强,ⅦA族元素从上到下非金属性减弱,非金属性越强,电负性越大,金属性越强,电负性越小;
B.电子排布为全满或半满时为稳定状态;
C.由基态转化成激发态,电子能量增大,需要吸收能量;
D.NaH中的H元素最低为-1,ⅦA族中元素的最低化合价为-1价.
解答 解:A.ⅠA元素从上到下,非金属性减弱,金属性增强,所以电负性从上到下逐渐减小;ⅦA族元素从上到下非金属性减弱,Ⅶ元素的电负性从上到下逐渐减小,故A错误;
B.电子排布为全满或半满时为稳定状态,最外层电子排布为ns2np6(若只有K层时为1s2)的原子,为稳定状态,不容易失电子,所以第一电离能较大,故B正确;
C.由基态转化成激发态,电子能量增大,需要吸收能量,碳原子由1s22s22p2转化成1s22s12p3,这一过程中会吸收能量,故C错误;
D.NaH中的H元素最低为-1,则H可以放在放在ⅦA族中,故D正确;
故选AC.
点评 本题考查元素电离能、电负性变化规律,明确电离能与失电子难易程度、电负性与得电子强弱关系是解本题关键,侧重考查运用知识解答问题能力,熟练掌握元素周期律知识,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$
CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$ CHCl-CH3(g)+HCl(g)△H>0
CHCl-CH3(g)+HCl(g)△H>0| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
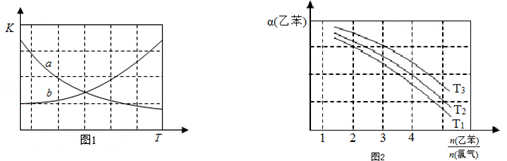
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)△H=+124kJ/mol
CH=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
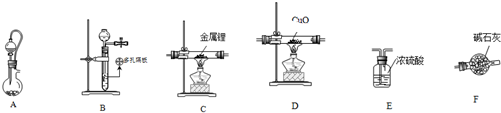
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
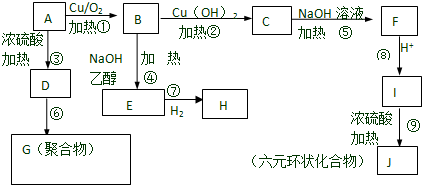
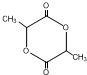 ;
;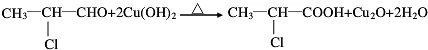 C→F
C→F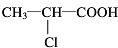 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$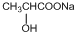 +NaCl+H2O
+NaCl+H2O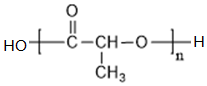 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com