
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
分析 设Na2CO3和NaHCO3固体的物质的量都为1mol,1mol碳酸氢钠加热分解生成0.5molNa2CO3,碳酸钠的物质的量不同,则消耗盐酸、生成二氧化碳的物质的量不同,前者消耗盐酸较多,后者生成二氧化碳为前者的一半,据此进行解答.
解答 解:Na2CO3和NaHCO3固体的物质的量都为1mol,1mol碳酸氢钠加热分解生成0.5molNa2CO3,
A.前者碳酸钠为1mol,后者为0.5mol,显然后者消耗的盐酸较多,故A错误;
B.加热后碳酸钠的物质的量不同,则生成二氧化碳的量不同,故B错误;
C.前者碳酸钠的物质的量较大,则前者消耗盐酸反应后者,故C错误;
D.前者碳酸钠的物质的量为后者的2倍,加入盐酸质量,根据C原子数守恒可知:后者放出CO2的量是前者的一半,故D正确;
故选D.
点评 本题考查了碳酸钠、碳酸氢钠的性质、化学方程式的计算,题目难度不大,明确加热后固体组成为解答关键,注意掌握碳酸钠、碳酸氢钠的性质,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 通入大量NO,ν正、ν逆均增大 | |
| B. | 恒温恒容下充入Ne,ν正、ν逆均不变 | |
| C. | ν正(NO)=2ν逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
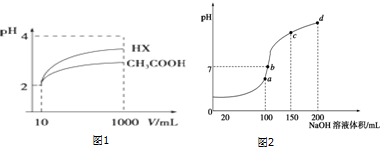
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下溶解度比碳酸钠要大 | |
| B. | 热稳定性比碳酸钠要差 | |
| C. | 只能和酸反应不能和碱反应 | |
| D. | 和酸反应放出等量的二氧化碳,所消耗的酸比碳酸钠多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
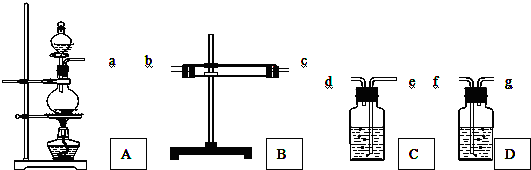
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管内液体加热时,液体体积不应超过试管容积的$\frac{1}{3}$ | |
| B. | 过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体 | |
| C. | 测定某溶液的pH将干燥试纸浸入到待测溶液,过一会儿取出,与标准比色卡比较 | |
| D. | 用容量瓶配置一定物质的量浓度溶液时,容量瓶必须干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

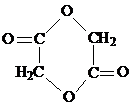 .
.


 (任写其中一种).
(任写其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将铜丝放在火焰上烧热,迅速插入乙醇中,可观察到铜丝表面由黑色变为红色,反复操作几次.还能闻到刺激性气味 | |
| B. | 向鸡蛋清溶液屮加入饱和硫酸铵溶液,有白色固体析出,再加入蒸馏水,振荡,固体又重新溶于水 | |
| C. | 向淀粉溶液中加入少量稀硫酸,加热4~5 min,待溶液冷却后,加入少量碘水,溶液呈蓝色,说明淀粉没有水解 | |
| D. | 取5mL0.1 mol•L-1 FeCl3,溶液,滴加0.1 mol•L1 KI溶液5~6滴,振荡,再加入少量KSCN溶液,溶液呈红色,说明该反应有一定的限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com