
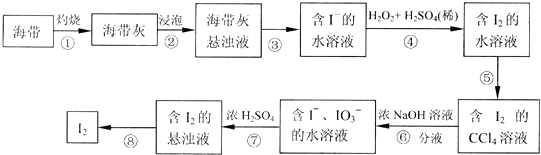
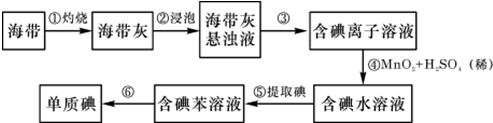
分析 海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质;
(1)灼烧固体需要使用仪器坩埚;
(2)酸性条件下的过氧化氢做氧化剂氧化碘离子为碘单质,本身被还原为水;
(3)从碘水中提取碘的方法为萃取分液;
(4)经步骤⑤得到含I2的CCl4溶液后,需要从I2的CCl4溶液中分离出I2;
(5)发生反应为:5I-+IO3-+6H+=3I2+3H2O,故由1molIO3-发生反应时,转移5mol电子.
解答 解:海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质;
(1)灼烧固体需要使用仪器坩埚,故答案为:b;
(2)酸性条件下的过氧化氢做氧化剂氧化碘离子为碘单质,本身被还原为水,反应为2I-+H2O2+2H+=I2+2H2O,故答案为:2I-+H2O2+2H+=I2+2H2O;
(3)从碘水中提取碘的方法为萃取分液,故答案为:萃取、分液;
(4)经步骤⑤得到含I2的CCl4溶液后,需要从I2的CCl4溶液中分离出I2,故答案为:从I2的CCl4溶液中分离出I2;
(5)发生反应为:5I-+IO3-+6H+=3I2+3H2O,故由1molIO3-发生反应时,转移5mol电子,故答案为:5.
点评 本题考查海带成分中碘的检验,注意掌握萃取和分液的使用条件,书写离子方程式的方法及相关计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s轨道呈球形,处在该轨道上的电子只能在球壳内运动 | |
| C. | p轨道呈哑铃形,在空间有两个伸展方向 | |
| D. | 与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、淀粉的最简式都是CH2O | B. | 醋酸钠的分子式:CH3COONa | ||
| C. | CH4的电子式是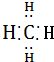 | D. | 丙烷分子的球棍模型是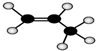 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
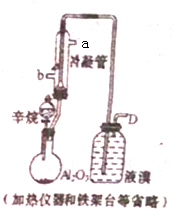 现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题:
现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题:查看答案和解析>>
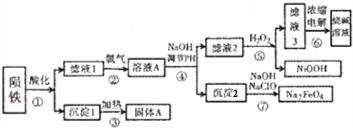
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
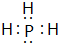 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物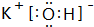 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com