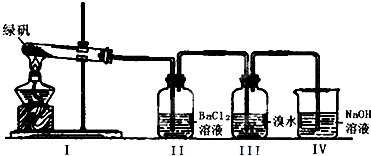
菠菜中含有一定量的草酸(HOOC-COOH)及草酸亚铁,现通过实验探究草酸和草酸亚铁的性质.
Ⅰ.探究草酸的性质
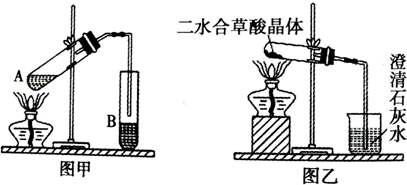
(1)向图甲装置的A试管加入3mL乙醇,然后边震荡试管边加入2mL浓硫酸和2mL草酸,按图甲链接好装置,加热3~5分钟,在B试管中有油状液体产生.该现象说明了反应(填有机反应类型)
.导管口在B试管液面上侧附近的原因
.
(2)已知草酸分解的化学方程式为H
2C
2O
4H
2O+CO
2↑+CO↑.
通常情况下草酸是以二水合草酸晶体(熔点:101.5℃)的形式存在,现用乙装置加热二水合草酸晶体,验证草酸的受热分解产物,但有同学认为该装置不合理.请你根据题给的某些物理常数和试验目的,指出不合理的原因
、
; (回答两条即可)
Ⅱ.探究草酸亚铁的热分解规律
将1.000克固体FeC
2O
4?2H
2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下表:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
(1)写出25~300℃时,固体发生变化的化学方程式
.
(2)500℃时,产物中氧元素的质量分数为
.
(3)写出600~900℃时,发生变化的化学方程式
.




 初中学业考试导与练系列答案
初中学业考试导与练系列答案