
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下:

已知:①镓在元素周期表中位于第四周期第ⅢA,化学性质与铝相似。
②lg2=0.3,lg3=0.48。
③部分物质的Ksp如F表所示
物质 |
|
|
|
|
Ksp |
|
|
|
|
(1)滤渣1的主要成分是_________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)___________。
(3)调pH的目的是______;室温条件下,若浸出液中各阳离子的浓度均为0.01 mol/L,当溶液中某种离子浓度小于![]() mol/L时即认为该离子已完全除去,则pH应调节的范围为_______。
mol/L时即认为该离子已完全除去,则pH应调节的范围为_______。
(4)操作D包括:__________过滤、洗涤、干燥。
(5)制备、精炼金属Ga。
①电解法制备金属镓。用惰性电极电解![]() 溶液即可制得金属镓,写出阴极电极反应式_________。
溶液即可制得金属镓,写出阴极电极反应式_________。
②电解法精炼金属镓(粗镓含Zn、Fe、Cu等杂质,已知氧化性:![]()
下列有关电解精炼金属镓的说法正确的是_______(填字母序号)。
A .电解精炼镓时粗镓与电源的正极相连
B. 电解精炼过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,Cu和Fe沉积在电解槽底部形成阳极泥
D. 若用甲烷燃料电池电解精炼金属镓,当阴极有56.0 g镓析出时,电池负极最多消耗标准状况下的![]() 6.72 L
6.72 L
【答案】![]()
![]()
![]() 使
使![]() 、
、![]() 沉淀完全面
沉淀完全面![]() 不沉淀 5.48<pH<6.6 蒸发浓缩,冷却结晶
不沉淀 5.48<pH<6.6 蒸发浓缩,冷却结晶 ![]() AC
AC
【解析】
Ga的性质与Al相似,锌矿渣中加入H2SO4,充分反应,其中Zn、Fe、Ga转化为可溶于水的ZnSO4、FeSO4、Ga2(SO4)3,Pb转化成难溶于水的PbSO4,SiO2与H2SO4不反应,经过滤得到的滤渣1中成分为PbSO4、SiO2; 向浸出液中加入H2O2,H2O2将Fe2+氧化成Fe3+,然后调节溶液的pH使Fe3+、Ga3+转化为氢氧化物沉淀与Zn2+分离;滤渣2的成分为Fe(OH)3和Ga(OH)3,根据图示应向滤渣2中加入NaOH使Ga(OH)3溶解转化为NaGaO2。据此解答。
(1)根据上述分析,滤渣1的成分为SiO2、PbSO4;
(2)Fe2+具有还原性,H2O2将Fe2+氧化成Fe3+,反应的方程式是:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据流程中物质转化关系可知调pH的目的是将Fe3+、Ga3+转化为氢氧化物沉淀,Zn2+不能形成Zn(OH)2,从而与Zn2+分离;Fe(OH)3和Ga(OH)3属于同种类型,![]() >Ksp[
>Ksp[![]() ],Ga3+完全沉淀时Fe3+已经完全沉淀,浓度小于
],Ga3+完全沉淀时Fe3+已经完全沉淀,浓度小于![]() mol/L,c(OH-)=
mol/L,c(OH-)= =
=![]() =
=![]() mol/L,c(H+)=
mol/L,c(H+)=![]() mol/L,pH=-lg
mol/L,pH=-lg![]() =5.48,Zn2+开始沉淀时c(OH-) =
=5.48,Zn2+开始沉淀时c(OH-) = =
=![]() =
=![]() mol/L,c(H+)=
mol/L,c(H+)=![]() mol/L,pH=-lg
mol/L,pH=-lg![]() =6.6,则pH应调节的范围为5.48<pH<6.6
=6.6,则pH应调节的范围为5.48<pH<6.6
(4)操作D包括:蒸发浓缩,冷却结晶、过滤、洗涤、干燥等;
(5)①电解NaGaO2溶液生产Ga,Ga元素的化合价由+3价降为0价,GaO2-转化为Ga为还原反应,电解时还原反应在阴极发生,阴极的电极反应式为:![]() ;
;
②电解精炼镓时粗镓与电源的正极相连,离子氧化性顺序为:Zn2+<Ga2+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ga>Fe>Cu,则阳极上Zn、Ga失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液,则阳极泥成分是Fe、Cu,阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为![]() ;甲烷燃料电池负极电极反应:CH4+10OH--8e-=CO32-+7H2O,所以
;甲烷燃料电池负极电极反应:CH4+10OH--8e-=CO32-+7H2O,所以
8Ga ~ 3CH4
8×70g 3×22.4L
56g 6.72L
但是电解精炼镓时能量的利用率达不到100%,实际耗电所消耗标准状态下的![]() 大于6.72L。故说法正确的是AC。
大于6.72L。故说法正确的是AC。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑+ 2H2O
(1)浓盐酸在反应中显示出来的性质是 ________(填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为 ___________;
(3)该反应中氧化产物与还原产物的质量比为____________;
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目______
(5)铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是__________ (填写字母)
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+ C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
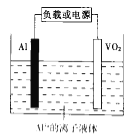
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: __________________。
⑵ 反应A可自发进行的温度条件是________(填“低温”或“高温”) 。
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件___________。
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
① 由上图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为________________(用分数表示)。
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

⑸ 阳极反应式为__________________________________。
⑹ 除去NH4+的离子反应方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、X、Y、Z、W在元素周期表中的相对位置如下表所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是

A. 离子半径:X<Y<W
B. 最简单气态氢化物的热稳定性:W<Z
C. ![]() 分子中每个原子均满足8电子稳定结构
分子中每个原子均满足8电子稳定结构
D. 最高价氧化物对应水化物的碱性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服抗菌药利君沙的制备原料E和某种广泛应用于电子电器领域的高分子化合物H的合成路线如下:
已知:

I、核磁共振氢谱显示E分子中有两组峰,且峰面积比为2:1
Ⅱ、![]()
![]()
![]()
Ⅲ、
回答下列问题:
(1)丙烯的结构简式为_______________;E的分子式为_____________________;
(2)B分子中官能团的名称为__________________;G的名称为_______________________。
(3)由甲苯生成F的反应类型为_________________。
(4)写出C→D的化学方程式________________________________________________。
(5)满足下列条件的G的同分异构体有_________种。
①苯环上有三个取代基。②遇![]() 溶液发生显色反应。
溶液发生显色反应。
③能和![]() 溶液反应生成
溶液反应生成![]() 。
。
(6)写出1,3-丁二烯(![]() )和乙二醇(
)和乙二醇(![]() )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 1L 1mol/L CH3COONa 溶液中含有 CH3COO-的数目为 NA
B. 100 ml 1.0 mol·L-1 FeCl3 溶液与足量 Cu 反应,转移的电子数为 0.2NA
C. 标准状况下,11.2 L CCl4 中含有 C—Cl 键的数目为 2NA
D. NA 个 D2O 分子中,含有 10NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com