
【题目】请按要求回答下列问题。
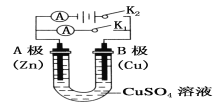
(1)根据上图回答①②:
①打开K2,闭合K1。
A电极可观察到的现象是________________________________;
B极的电极反应式为___________________________________。
②打开K1,闭合K2。
A电极可观察到的现象是__________________________________;
B极的电极反应式为_____________________________________。
(2)根据下图回答③④:
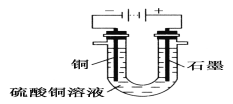
③将较纯净的CuSO4溶液放入上图所示的装置中进行电解,石墨电极上的电极反应式为___________________________________________________________,
电解反应的离子方程式为__________________________________________;
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
【答案】(1)①锌不断溶解 Cu2++2e-===Cu ②电极表面有红色固体附着 Cu-2e-===Cu2+
(2)③4OH--4e-===2H2O+O2↑2Cu2++2H2O![]() 2Cu+O2↑+4H+ ④
2Cu+O2↑+4H+ ④
【解析】
试题分析:(1)①若断开K2,闭合K1,形成原电池反应,Zn为负极,被氧化而锌不断溶解,Cu为正极,发生还原反应生成铜,电极方程式为Cu2++2e-═Cu;若断开K1,闭合K2,为电镀池,Cu为阳极,被氧化,发生Cu-2e-═Cu2+,Zn为阴极,发生还原反应,锌极镀上一层红色的铜。
(2)③电镀时,石墨为阳极,发生氧化反应,电极方程式为4OH--4e-═2H2O+O2↑,生成氧气,铜为阴极,总反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;④铜电极增重a g,n(Cu)=a/64mol,转移a/32mol电子,石墨电极反应4OH--4e-═2H2O+O2↑,生成n(O2)=a/4×32mol,则体积为(a/4×32)mol×22.4L/mol=L。
2Cu+O2↑+4H+;④铜电极增重a g,n(Cu)=a/64mol,转移a/32mol电子,石墨电极反应4OH--4e-═2H2O+O2↑,生成n(O2)=a/4×32mol,则体积为(a/4×32)mol×22.4L/mol=L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的H2和I2(g)加入密闭容器中进行反应:H2+I2(g)![]() 2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
2HI,反应进行到2min时测得反应速率υ(HI)=0.1mol/(L·min),I2(g)的物质的量浓度为0.4mol/L。
(1)反应速率υ(I2)= 。
(2)2min未c(HI)= mol/L。
(3)起始时,c(H2)= mol/L,反应进行到2min时,容器中I2所占的体积分数是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,写出该反应的热化学方程式__________。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,共放出QkJ热量(假定热量未损失),则CH4和CO的物质的量的比为__________。
(2)利用甲烷的燃烧反应设计一个燃料电池,用氢氧化钾溶液作电解质溶液.多孔石墨作电极,在电极上分别通入甲烷和氧气,通入甲烷气体的电极上发生的电极反应是___________,当电路中转移12mol电子时,实际提供的电能是890.0kJ,则该电池的能量转化效率是__________。
(3)将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中形成如图装置:

①当开关K1闭合,则铁发生电化学腐蚀中的__________腐蚀。
②当开关K2闭合,则总反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:

(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )
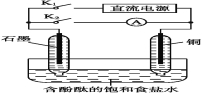
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-![]() 2Cl-
2Cl-
D.断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术] 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为: ;
②硫酸钠和焦炭、石灰石反应的化学方程式为: (已知硫酸钠做氧化剂,生成物中气体只有一种)。
(2)氨碱法的工艺如图所示,得到的碳酸氢钠经煅烧生成纯碱。

①图中的中间产物C是_______,(填化学式,下同)D是_______;
②装置乙中发生反应的化学方程式为 。
(3)联合制碱法是对氨碱法的改进,其优点是除了副产物氯化铵可用作化肥外还有______________。
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是
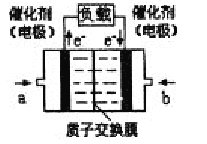
A.右电极为电池正极,b处通入的物质是空气
B.左电极为电池负极,a处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e—=CO2+6H+
D.正极反应式为:O2+4H++4e—=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com