
| A. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 由c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- | |
| D. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Mg2+、Cu2+、SO42-、K+ |
分析 A.加铝粉能产生大量H2的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气;
B.使甲基橙变红色的溶液中存在大量氢离子,碳酸氢根离子与氢离子反应;
C.由c(H+)/c(OH-)=10-12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.水电离出的c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,镁离子、铜离子与氢氧根离子反应.
解答 解:A.加铝粉能产生大量H2的溶液呈酸性或强碱性,NH4+与氢氧根离子反应,酸性条件下NO3-与铝反应不会生成氢气,故A错误;
B.使甲基橙变红色的溶液呈酸性,溶液中存在大量氢离子,HCO3-与氢离子反应生成二氧化碳和水,在溶液中不能大量共存,故B错误;
C.由c(H+)/c(OH-)=10-12的溶液呈碱性,溶液中存在大量氢氧根离子,K+、Na+、ClO-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.水电离出的c(H+)=10-12mol•L-1的溶液呈酸性或碱性,溶液中存在大量氢离子或氢氧根离子,Mg2+、Cu2+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
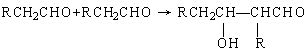

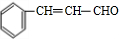 ;F
;F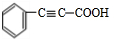 .
.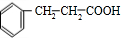 +
+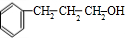 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$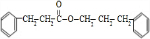 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 L l mol•L-1 Na2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 标准状况下,22.4 L氦气中含有的原子数为2NA | |
| C. | 100 g 98%的浓硫酸中,氧原子总数为4NA | |
| D. | 4.6 g组成为C2H6O的有机物,C-H键数目不一定为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不溶于水,密度比水大 | |
| B. | 苯不能发生氧化反应 | |
| C. | 除去苯中混有的少量甲苯,可以用酸性高锰酸钾溶液 | |
| D. | 苯可以跟溴水反应制取溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原剂只有FeSO4 | |
| B. | 每生成1mol Na2FeO4只转移5mol的电子 | |
| C. | K2FeO4作为水处理剂时仅起杀菌消毒的作用 | |
| D. | 该反应在水溶液中进行并不影响高铁酸钾的生产 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是原电池、乙是电解池 | |
| B. | 铜电极上的电极反应式均为Cu2++2e-=Cu | |
| C. | 甲装置放电效率高于乙装置 | |
| D. | 当有6.5 g Zn溶解时,乙装置中会有0.2 mol电子通过盐桥 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量的氯化钡溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅲ成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com