
| A. | H2 | B. | CO | C. | H2和CO的混合物 | D. | CH4 |
分析 这些物质完全燃烧后生成CO2或H2O或二者都有,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2H2O=4NaOH+O2、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2Na2O2+2CO2=2Na2CO3+O2,根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成符合(CO)m•(H2)n就满足题意.
解答 解:这些物质完全燃烧后生成CO2或H2O或二者都有,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2H2O=4NaOH+O2、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2Na2O2+2CO2=2Na2CO3+O2,根据反应方程式可知,过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成符合(CO)m•(H2)n就满足题意,
根据分子式知,只有甲烷化学式不符合(CO)m•(H2)n,故选D.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,明确反应前后固体质量增加量成分是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的 | |
| B. | 乙同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸 钠水解是吸热的 | |
| D. | 丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸气)后若红色加深,说明醋酸钠水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
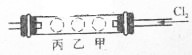 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
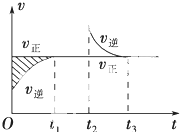 某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下均为非气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com