
 短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.
短周期元素置X、Y、R、Q在元素周期表中的位置如图所示,其中Q元素是地壳中含量最高的元素.| 浓度/mol?L-1 时间/min |
NO | N2 | RO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
25 12 |
25 12 |
| (1-0.58)mol/L |
| 10min |
| 0.3×0.3 |
| (0.4)2 |


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| B、元素X和Q形成的化合物中不可能含有共价键 |
| C、X、Z、M的单质分别与水反应,Y最剧烈 |
| D、Y的氢化物的水溶液可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
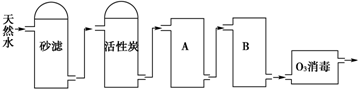
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2E<H2D |
| B、单质与稀盐酸反应的速率为A>C |
| C、B与E形成的化合物属于分子晶体 |
| D、A2+与D2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质不能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com