
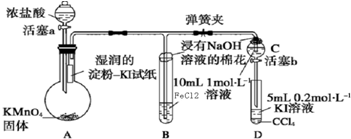
| 1 |
| 2 |
| 1 |
| 2 |
| 2.24L |
| 22.4L/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、①③ | B、①④ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、NH3、HCl |
| B、H3PO4、H2O、Cu |
| C、H2SO4、HNO3、BaCl2 |
| D、液态KNO3、NaOH溶液、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 锌金属活动性比铁强 | 海轮外壳上装锌块可减缓腐蚀 |
| B | Ba(OH)2可与盐酸反应 | Ba(OH)2可用于治疗胃酸过多 |
| C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
| D | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③⑤⑥⑦ |
| C、④⑤⑥⑦ | D、①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1.0 mol?L-1的NaAlO2水溶液中含有AlO2-为NA |
| B、1mol Na被完全氧化生成Na2O2,一定失去NA个电子 |
| C、1L 1 mol?L-1的盐酸含有NA个HCl分子 |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量的CO2通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| B、将Na2CO3溶液逐滴滴入盐酸中:2H++CO32-=CO2↑+H2O |
| C、SO2使紫色石蕊溶液变红色:SO2+H2O?2H++SO32- |
| D、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com