
| A、常温下Na与足量的氧气反应生成Na2O,随温度升高生成Na2O的速率加快 |
| B、常温下pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,两溶液中水电离的c(H+)之比为104:1 |
| C、凡是放热反应都是自发进行的反应,而吸热反应都是非自发进行的反应 |
| D、pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |


科目:高中化学 来源: 题型:
| 放电 |
| 通电 |
| A、充电时,外接电源的正极与电池上标注“-”的电极连接 |
| B、电池工作时,H+由正极流向负极 |
| C、电池放电时,负极的电极反应为VO2++H2O=VO2++2H++e- |
| D、电池充电时,阴极的电极反应为V3++e-=V2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
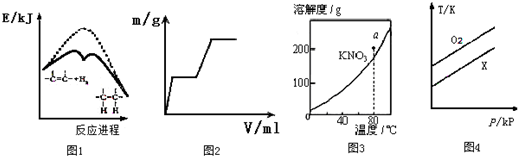
| A、图1说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
| B、向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系有可能是图2 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液在80℃时不可能存在 |
| D、在体积相同的两个密闭容器中,分别充入等质量的O2和X气体,由图4可确定X可能是CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有强氧化性和吸水性 |
| B | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡静置 | 下层溶液呈红棕色 | 氧化性:Cl2>Br2 |
| C | 将FeCl3溶液滴加到Mg(OH)2悬浊液中,振荡 | 白色沉淀变为红棕色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| D | 向SO2水溶液中滴加盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | BaSO3难溶于盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用SO2漂白品红溶液,加热溶液又恢复红色 |
| B、用带玻璃塞的玻璃试剂瓶盛装NaOH溶液 |
| C、用食醋清洗暖瓶中的水垢 |
| D、用铁制或铝制容器运输浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| A、21:5 | B、11:3 |
| C、3:1 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将Cl2通入品红溶液 | 溶液红色褪去 | Cl2具有较强还原性 |
| B | 常温下将Fe片放入稀硝酸中 | 产生无色可燃气体 | Fe与稀硝酸反应放出H2 |
| C | 往Na2CO3溶液中滴加稀盐酸,边滴边振荡 | 溶液开始无气泡产生, 需滴加一定量盐酸才能产生气泡 | CO32-+H+=HCO3- HCO3-+H+=H2O+CO2↑ |
| D | 往硫酸铝溶液通入过量氨气 | 产生白色沉淀 | Al(OH)3不溶于氨水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:X<Z<W |
| B、Y的阳离子半径比W的阴离子半径小 |
| C、X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W |
| D、室温下,含Y元素的盐形成的水溶液其pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数K的大小能说明反应的限度,因此当平衡右移时,K值必定增大 |
| B、可逆反应达到平衡状态后,改变外界条件后,若反应速率发生变化,则平衡一定发生移动 |
| C、若反应2A(g)+B(g)?2C(g)是自发反应,则该反应的△H<0 |
| D、使用催化剂可降低反应活化能,加快反应速率,改变反应限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com