
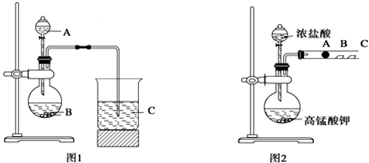
分析 (1)元素的非金属性越强,其最高价含氧酸的酸性越强,由图可知应是利用最高价含氧酸的酸性强弱比较,利用强酸制弱酸原理分析;
(2)B为常见的建筑材料为碳酸钙,图1烧瓶中盐酸和碳酸钙反应,烧杯中为二氧化碳与硅酸钠反应,注意二氧化碳量不同,产物不同;
(3)氯化氢易挥发,氯化氢能和硅酸盐反应,干扰二氧化碳和硅酸盐的反应,需在装置B与装置C之间添加吸收HCl的装置;
(4)浓盐酸和高锰酸钾在常温下发生氧化还原反应生成氯气,非金属性Cl>Br>I,单质的氧化性Cl2>Br2>I2,卤素单质之间可发生置换反应;
(5)通过B处的气体主要是氯气,氯气能氧化碘离子,I2与淀粉作用显示蓝色;
(6)B处氯气氧化碘离子生成碘单质.
解答 解:(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,盐酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为盐酸,B为常见的建筑材料为碳酸钙,C为硅酸钠溶液,化学式分别为:HCl、CaCO3、Na2SiO3,
故答案为:HCl;CaCO3;Na2SiO3;
(2)图1烧瓶中盐酸与碳酸钙反应生成二氧化碳、氯化钙和水,其反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,烧杯中为二氧化碳与硅酸钠反应,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或是SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量),
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足)或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量);
(3)B中盐酸与碳酸钙反应,由于反应中盐酸具有挥发性,可能是挥发出的盐酸溶于水与硅酸钠反应生成硅酸沉淀,所以会对二氧化碳与硅酸钠的反应产生干扰,该装置的不足装置B与装置C之间缺少吸收HCl的装置,
故答案为:装置B与装置C之间缺少吸收HCl的装置;
(4)由图2,根据题意,浓盐酸与高锰酸钾反应会生成氯气,其反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,然后氯气经过B处会与KI反应生成I2,Cl2+2KI═2KCl+I2,单质的氧化性Cl2>Br2>I2,由此可知,验证卤族元素性质的递变规律的实验原理是:强氧化剂生成弱氧化剂或活泼的非金属单质置换出较不活泼的非金属单质,
故答案为:强氧化剂生成弱氧化剂或活泼的非金属单质置换出 较不活泼的非金属单质;
(5)氯气在B处与KI反应生成单质碘,碘单质与淀粉作用会变成蓝色,即B处的实验现象是:湿润的淀粉KI试纸变蓝,
故答案为:湿润的淀粉KI试纸变蓝;
(6)氯气的氧化性强于碘单质,B处氯气与KI反应的化学方程式是:Cl2+2KI═2KCl+I2,其离子方程式是:2I-+Cl2?I2+2Cl-,故答案为:2I-+Cl2?I2+2Cl-.
点评 本题考查探究元素周期律实验方案设计,综合运用元素及其化合物、元素周期律与非金属性强弱比较的有关知识是解答关键,具有较强的综合性,注意实验设计的原理和方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 7 | B. | 5 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
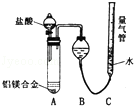 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
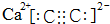 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°;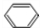 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$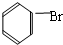 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应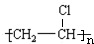 其反应类型为加聚反应
其反应类型为加聚反应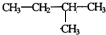 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
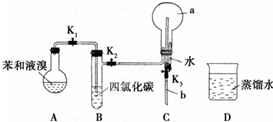
 ,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.
,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11 | B. | 15 | C. | 22 | D. | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水鉴别甲苯、己烷、己烯 | |
| B. | 将稀硫酸、稀硝酸和苯混合加热制硝基苯 | |
| C. | 苯和硝基苯混合物采用分液的方法分离 | |
| D. | 用CuSO4溶液除去由电石和水反应生成的乙炔气体中的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 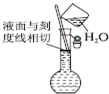 配制一定物质的量浓度溶液 | |
| B. | 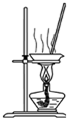 蒸干氯化锰溶液制MnCl2•4H2O | |
| C. | 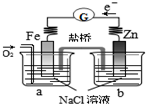 验证牺牲阳极的阴极保护,在a烧杯中滴入K3[Fe(CN)6]溶液,无蓝色沉淀产生 | |
| D. |  萃取时振荡溶液 |
查看答案和解析>>
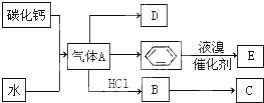
科目:高中化学 来源: 题型:推断题
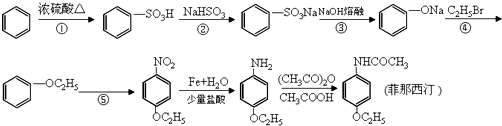
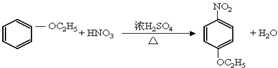 ;
;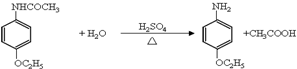 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com