
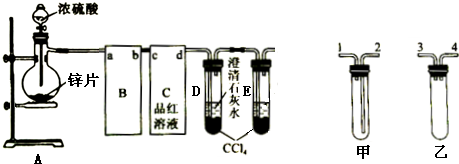
分析 (1)根据仪器的构造写出其名称;
(2)B装置为安全瓶,防止倒吸,应该装置甲;C用品红溶液具有二氧化硫,导管应该长进短出;
(2)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,可防止倒吸;
(3)浓硫酸中硫为+6价,具有强氧化性,被锌还原为+4价的硫,则品红溶液褪色可以证明浓硫酸具有强氧化性;
(4)二氧化硫与氢氧化钙反应生成亚硫酸钙沉淀;
(5)锌与稀硫酸反应生成硫酸锌和氢气;
(6)锌和浓硫酸反应生成硫酸锌和二氧化硫和水,当硫酸浓度变稀时,锌与稀硫酸反应生成硫酸锌和氢气,用无水硫酸铜检验水的存在,品红检验二氧化硫的存在,氧化铜检验氢气的存在;
(7)二氧化硫能够与氢氧化钠溶液反应,通常用氢氧化钠溶液吸收二氧化硫.
解答 解:(1)根据图示可知,A装置中,盛装锌片的仪器名称为蒸馏烧瓶,故答案为:蒸馏烧瓶;
(2)通常状况下,1体积水中可溶解40体积的二氧化硫气体,装置乙可防止二氧化硫与品红作用时被吸入锌与硫酸反应的容器中;二氧化硫与品红溶液作用,需长管进,所以导管连接顺序为:a接4(或3)→b→c→2,
故答案为:3(或4);2;
(3)二氧化硫易溶于水,难溶于四氯化碳,二氧化硫通过四氯化碳,然后再与澄清的石灰水反应,起缓冲作用,可防止倒吸,
故答案为:防止倒吸;
(4)二氧化硫可使品红溶液褪色,则C中品红溶液褪色可检验二氧化硫的存在,从而证明浓硫酸具有强氧化性,
故答案为:C中品红溶液褪色;
(5)二氧化硫和澄清的石灰水反应生成亚硫酸钙和水,亚硫酸钙为难溶于水的沉淀,离子反应为Ca2++2OH-+SO2═CaSO3↓+H2O,
故答案为:Ca2++2OH-+SO2═CaSO3↓+H2O;
(6)锌为较活泼的金属,在金属活动顺序表中排在氢的前面,所以锌和稀硫酸反应生成硫酸锌和氢气,反应为Zn+H2SO4(稀)═ZnSO4+H2↑,故答案为:Zn+H2SO4(稀)═ZnSO4+H2↑;
(7)二氧化硫有毒,且能够与氢氧化钠溶液反应,多余的二氧化硫可用氢氧化钠溶液吸收,防止污染空气,
故答案为:氢氧化钠溶液.
点评 本题考查浓硫酸的性质,题目难度中等,明确浓硫酸、稀硫酸分别与锌反应的原理为解答关键,注意熟练掌握二氧化硫的性质及检验方法,试题知识点较多,考查较全面,有利于培养学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物是离子化合物,且最外层电子均满足8电子结构的 | |
| B. | 工业上通常采用电解Y的熔融氧化物的方法制得Y | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X和Z的最高价氧化物对应的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
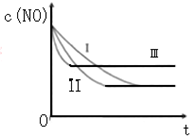 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验 编号 | T/°C | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比 表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
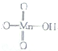 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多植树造林,严禁乱砍滥伐 | B. | 使用新能源,减少煤炭使用 | ||
| C. | 少开私家车,控制尾气排放 | D. | 杜绝浪费,实施“光盘行动” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com