

 ×100%=102.5%,故答案为:102.5%;
×100%=102.5%,故答案为:102.5%;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2014届江苏省扬州市高二上学期期末考试化学试卷(解析版) 题型:实验题
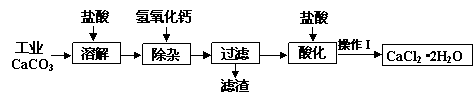
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:

(1)CaCO3与盐酸反应的离子方程式 。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ⑤ 等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为 。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 引起的(填序号),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
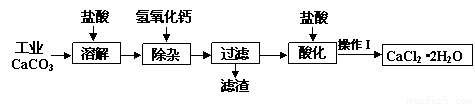
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:

(1)CaCO3与盐酸反应的离子方程式 ▲ 。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣
主要成分的化学式为 ▲ ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 ▲ 。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 ▲ 。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ▲ ⑤ ▲ 等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL
0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为 ▲ 。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 ▲ 引起的(填序号),理由是 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高二(上)期末化学试卷(必修)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com