
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。用该废料制备纯度较高的氢氧化镍,工艺流程如图所示:
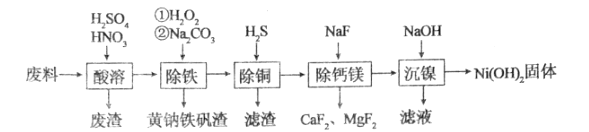
请回答下列问题:
(1)为了提高“酸溶”工序中原料的浸出效率,采取的措施不合理的有______。
A.搅拌
B.适当升高温度
C.研磨矿石
D.用浓硫酸
(2)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是______;合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成,金属镍溶解的离子方程式为______。
(3)“除铁”时控制温度不超过40℃的原因是______;加入碳酸钠的目的是______。
(4)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,图表示pH-温度关系,图中阴影部分为钠铁矾稳定存在的区域。
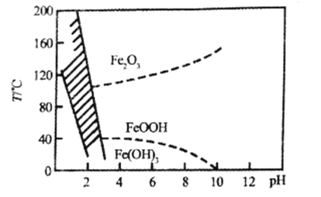
则下列说法不正确的是______(填字母)
a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 molNaClO3得到的电子数为6NA
d.工业生产中温度常保持在85℃-95℃,控制溶液的pH为1.2~1.8,此时加入Na2SO4后生成黄钠铁矾
(5)“除铜”时,反应的离子方程式为______,若用Na2S代替H2S除铜,优点是______。
(6)已知某温度下Ksp[Ni(OH)2]=4.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5mol/L;lg2=0.30)。
【答案】D SiO2 5Ni+12H++2NO3-=5Ni2++N2↑+6H2O 温度过高过氧化氢分解,浓度降低 调节溶液pH,使Fe3+完全沉淀为黄钠铁矾 ab Cu2++H2S=CuS↓+2H+ 不会有易挥发的有毒气体H2S逸出,保护环境 9.3
【解析】
废料与稀硫酸、稀硝酸溶液反应生成硫酸亚铁、硫酸镍,双氧水具有强氧化性,加入双氧水的目的是将Fe2+氧化成Fe3+,加入碳酸钠调节pH,除去Fe3+,通入硫化氢除去Cu2+,硫化氢可与Cu2+反应生成CuS,加入氟化钠,可生成氟化钙、氟化镁沉淀,最后调节pH生成氢氧化镍沉淀,据此分析;
(1)“酸溶”中增大原料的利用率,可以采取的措施是搅拌、适当升高温度、粉碎(或研磨)、适当增加酸的浓度,但是不能用浓硫酸,因为铁与浓硫酸发生钝化反应,不符合该工艺流程,故D符合题意;
(2)废料是铁镍合金,含有CuO、CaO、MgO、SiO2,铁镍合金能与混酸反应转化成相应的离子,CuO、CaO、MgO为碱性氧化物,能与酸反应生成相应的离子,SiO2属于酸性氧化物,不溶于水,且不与硫酸和硝酸反应,因此废渣的主要成分是SiO2;镍与硝酸反应生成Ni2+和N2,其离子方程式为5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;
(3)除铁时需要加入H2O2,H2O2不稳定受热易分解,因此控制温度不超过40℃的原因是防止温度过高过氧化氢分解,浓度降低;加入碳酸钠的目的是调节pH,使Fe3+完全沉淀为黄钠铁矾;
(4)a.根据化合价代数和为0,推出Fe的化合价为+3价,故a说法错误;
b.根据图像,pH过低会将黄钠铁矾溶解,pH过高则不会生成黄钠铁矾,其原因不同,故b说法错误;
c.1molNaClO3氧化Fe2+,得到电子物质的量为1mol×1×[5-(-1)]=6mol,故c说法正确;
d.工业生产中温度常保持在85℃~95℃,加入Na2SO4后生成黄钠铁矾,结合图可知此时溶液的pH约为1.2~1.8,故d说法正确;
故答案选ab;
(5)根据流程,加入H2S除Cu2+,CuS不溶于硫酸,即发生离子方程式为Cu2++H2S=CuS↓+2H+;H2S具有臭鸡蛋气味的气体,有毒,污染环境,Na2S代替H2S,优点是不会有易挥发的有毒气体H2S逸出,保护环境;
(6)Ni2+才刚好沉淀完全时,c(Ni2+)小于等于10-5mol·L-1,根据溶度积得出,c(OH-)=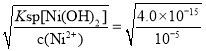 =2.0×10-5mol·L-1,pOH=5-lg2=5-0.3=4.7,即pH=14-4.7=9.3。
=2.0×10-5mol·L-1,pOH=5-lg2=5-0.3=4.7,即pH=14-4.7=9.3。


科目:高中化学 来源: 题型:
【题目】污染性气体NO2与CO在一定条件下发生的反应为2NO2(g)+4CO(g)4CO2(g)+N2(g),310K下,向1L的恒温恒容密闭容器中充入0.1mol NO2和0.2mol CO,5min后反应达到平衡,此时NO2的浓度为0.05mol/L。
(1)反应从开始到5min时,CO的平均反应速率v(CO)=________,NO2的平衡转化率a=________,310K时,上述反应的平衡常数K=________。
(2)在350K下,重复上述实验,平衡后NO2的物质的量分数为30%,则该反应的ΔH________(填“>”“<“或“=”)0。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):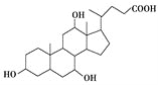
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程中Fe2(SO4)3可循环利用
B.由脱硫过程可知,氧化性强弱Fe2(SO4)3<S<O2
C.脱硫过程中O2间接氧化H2S
D.副产物硫单质可以用来制硫酸、化肥、火柴及杀虫剂等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__。
(2)丙溶液中存在的电离平衡为__(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是__(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能固氮反应条件苛刻,计算机模拟该历程如图所示,在放电的条件下,微量的O2或N2裂解成游离的O或N原子,分别与N2和O2发生以下连续反应生成NO。下列说法错误的( )
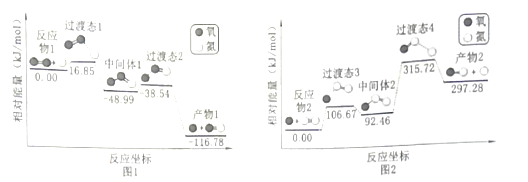
A.图1中,中间体1到产物1的方程式为O-O═N→O+N═O
B.NO的生成速率很慢是因为图2中间体2到过渡态4的能垒较大
C.由O和N2制NO的活化能为315.72kJmol-1
D.由N和O2制NO的过程比由O原子和N2制NO的过程速率慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com