
 的名称2-硝基甲苯(邻硝基甲苯).
的名称2-硝基甲苯(邻硝基甲苯). 分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
根据以上有机物的命名原则对各有机物进行命名或写出其结构简式.
解答 解:(1)2-甲基-1,3-丁二稀,主碳链四个碳原子,1,3号碳上分别有一个碳碳双键,2号碳上一个甲基,得到的结构简式为:CH2=C(CH3)-CH=CH2,
故答案为:CH2=C(CH3)-CH=CH2;
(2)2-丙醇是主碳链3个碳原子,2号碳上含一个羟基,结构简式为CH3CH(OH)CH3,故答案为:CH3CH(OH)CH3;
(3)以甲苯为母体,从甲基碳给苯环碳原子编号确定硝基位置,得到名称为2-硝基甲苯,或习惯命名为邻硝基甲苯,故答案为:2-硝基甲苯(邻硝基甲苯).
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物是乙醇和过量的3mol/L硫酸的混和液 | |
| B. | 温度计插入反应溶液液面以下,以便控制温度在140℃ | |
| C. | 反应容器(烧瓶)中应加入少许瓷片 | |
| D. | 反应完毕先灭火再从水中取出导管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H-) | B. | c(H+)>c(OH-) | ||
| C. | 2c(K+)+c(H+)═c(HS-)+2c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
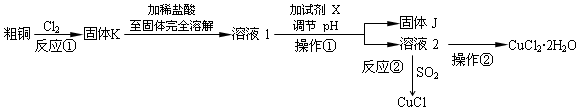
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
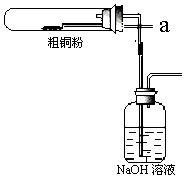
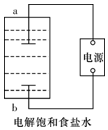 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②③④⑤ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com