
| A. | 合成高分子的小分子就是高分子的链节 | |
| B. | 缩聚反应的产物只有高分子 | |
| C. | 聚乙烯具有热塑性 | |
| D. | 1mol 水解后只能与1molNaOH反应 水解后只能与1molNaOH反应 |
分析 A.合成高分子的小分子为单体,重复出现的结构单元为高分子的链节;
B.缩聚反应生成高分子,还生成小分子,如水或HX等;
C.聚乙烯为线型结构,加热可熔化;
D. 中含n个-COOC-.
中含n个-COOC-.
解答 解:A.合成高分子的小分子为单体,重复出现的结构单元为高分子的链节,如合成聚乙烯的小分子为乙烯,乙烯为单体,而链节为-CH2-CH2-,故A错误;
B.缩聚反应生成高分子,还生成小分子,如水或HX等,而加聚反应产物只有高分子,故B错误;
C.聚乙烯为线型结构,加热可熔化,则具有热塑性,故C正确;
D. 中含n个-COOC-,则1mol该有机物水解,需要nmolNaOH,故D错误;
中含n个-COOC-,则1mol该有机物水解,需要nmolNaOH,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为基础性习题,把握合成高分子的方法、高分子的结构与性质为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol的-CH3含有的电子数为0.7NA | |
| B. | 18.8g苯酚分子中处于同一平面的原子数最多为2.6NA | |
| C. | 标准状况下,2.24L甲醛所含分子数为0.1NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示
在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | 乙酸的最简式:CH3COOH | ||
| C. | 苯甲醛的结构简式: | D. |  的系统命名为:4,4二甲基-2-戊烯 的系统命名为:4,4二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. |  3-乙基-1-丁烯 3-乙基-1-丁烯 | |
| C. | 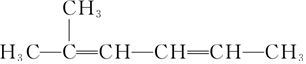 2-甲基-2,4-己二烯 2-甲基-2,4-己二烯 | |
| D. |  2,4,4-三甲基戊烷 2,4,4-三甲基戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com