
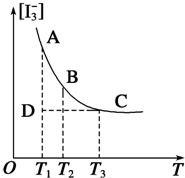
 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).分析 (1)温度升高时平衡移动的方向判断反应的反应热;
(2)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;反应为放热反应,升温平衡逆向进行,加入溴水会氧化碘离子生成碘单质,平衡逆向进行.
解答 解:(1)随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,I2(aq)+I-(aq)?I3-(aq) 是一个放热反应,即△H<0,故答案为:放热;
(2)I2(aq)+I-(aq)?I3-(aq),平衡常数K=$\frac{c({{I}_{3}}^{-})}{c({I}_{2})c({I}^{-})}$,(1)可知反应为放热反应,若升高温度,平衡逆向进行,K值将减小,若向溶液中加入少量的溴水,溴单质氧化碘离子平衡逆向进行,K值将减小,
故答案为:$\frac{c({{I}_{3}}^{-})}{c({I}_{2})c({I}^{-})}$;减小;减小.
点评 本题考查了好像反应能量变化、平衡常数及其影响因素等,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
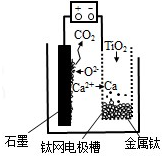 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A. | 将熔融CaF2-CaO 换成Ca 处理也可以达到相同目的 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb 电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 在该反应中,氧化产物有两种,还原产物有一种 | |
| C. | 若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大 | |
| D. | 在该反应中,每消耗22.4LNO必转移2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com