
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400 ℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式________________。K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是__________________。
(2)CN-中碳原子的杂化方式为____________;1 mol CN-中含有π键的数目为__________。
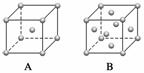
(3)金属钾、铜的晶体的晶胞结构如下图(请先判断对应的图),钾、铜两种晶体晶胞中金属原子的配位数之比为______________。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为________________。
科目:高中化学 来源: 题型:
实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1—溴丁烷,已知有关物质的性质如下:
| 熔点/℃ | 沸点/℃ | 密度/ | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1—溴丁烷 | -112.4 | 101.6 | 1.28 |
(1)生成1—溴丁烷的化学方程式为__________________。
(2)由于副反应的发生而可能产生的副产物有_______________。(至少两种,有机物用结构简式表示)
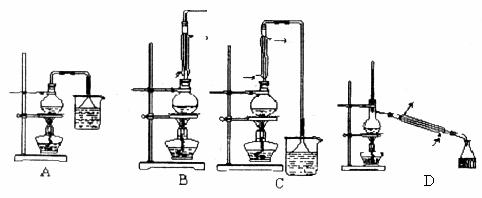
(3)为了将反应混合物中1—溴丁烷及时分离出,应选用的装置是_____________(填序号),该操作应控制的温度t2范围是_______________。
(4)在得到的1—溴丁烷的产物中出现了分层现象,某同学选择用分液的方法进行分离。在本实验分离过程中,产物应该从分液漏斗的___________(填“上口倒出”或“下口放出”)。
(5)本实验所用的正丁醇质量为20.0g,最后得到纯净的1—溴丁烷的质量为22.2g,本实验的产率约是_________(填正确答案标号)。
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2 L的戊烷所含的分子数为0.5NA
B.28 g乙烯所含共用电子对数目为4NA
C.1 mol甲基的电子数目为7 NA
D.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质或应用的说法,正确的是 ( )
A.制水泥和玻璃都用石灰石做原料
B.利用Al2O3制作的坩埚,可用于熔融烧碱
C.Si可用做太阳能电池和光导纤维的材料
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
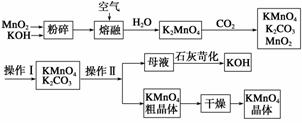
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式______________________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水
c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有________、________(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1 mol MnO2可制得____ mol KMnO4。
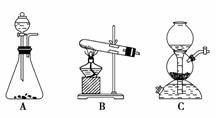
(5)该生产中需要纯净的CO2气体。写出实验室制取CO2的化学方程式________,所需气体产生装置是________(选填代号)。
(6)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碱金属元素性质的叙述中,正确的是 ( )
A.碱金属的单质中,锂的还原性最强
B.K与水反应最剧烈
C.在自然界中它们无游离态存在
D.单质的熔沸点依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口。请你解释这两个现象:
, (用电极反应式表示)。
Ⅱ、某同学根据离子方程式:2Fe3++Cu===2Fe2++Cu2+
设计了一套原电池装置,从而实现了该反应。请完成下列各题:
(1)该原电池的负极材料为 ,电解质溶液可能是 (填溶质的化学式)。
(2)在下面方框中画出该原电池的示意图(正极材料为碳棒)。

查看答案和解析>>
科目:高中化学 来源: 题型:
及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着 个σ键和————个π键;
(3)氮、氧、氟是同周期相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②氮原子的电负性 (填“大于”、“小于”或“等于”) 氧原子的电负性;
(4)氮元素的氢化物——NH3是一种易液化的气体,该气体易液化的原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com