
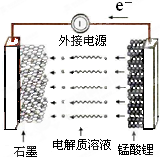
 使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC
使用锂离子电池为动力汽车,可减少有害气体的排放.锰酸锂离子蓄电池的反应式为:Li1-xMnO4+LixC| 放电 |
| 充电 |
| A、充电时电池内部Li+向正极移动 |
| B、放电过程中,电能转化为化学能 |
| C、放电时电池的正极反应式为:Li1-xMnO4+xe-+xLi+=LiMnO4 |
| D、充电时电池的正极应与外接电源的负极相连 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研制具有生物功能的材料制造人工器官 |
| B、把水变成汽油解决能源短缺的问题 |
| C、寻找更好的催化剂在常温常压下合成氨 |
| D、研究生命活动的物质揭示生命现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
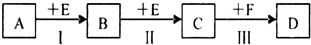
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | AgCl沉淀中滴入Na2S溶液 | 白色沉淀变黑色 | Ksp(Ag2S)<Ksp (AgCl) |
| B | 向浑浊的苯酚试液中加入饱和Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| C | 蔗糖溶液在硫酸存在下水浴一段时间后,再与银氨溶液混合加热 | 无银镜出现 | 蔗糖没有水解 |
| D | 取少量卤代烃Y在碱性溶液中水解后,先加硝酸酸化,再滴加AgNO3溶液 | 生成白色沉淀 | 说明卤代烃中含有氯原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
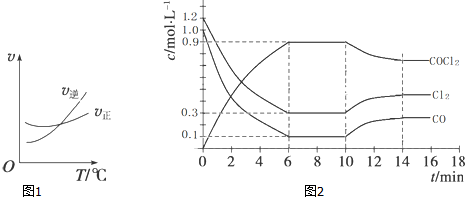
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物 |
| B、用大理石和浓盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中,出现白色沉淀证明H2CO3的酸性比H2SiO3的酸性强 |
| C、向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42- |
| D、相同体积pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(CH4) |
| n(N2) |
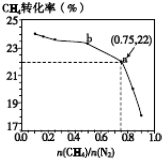
A、
| ||
B、
| ||
| C、b点对应的平衡常数比a点的大 | ||
| D、a点对应的NH3的体积分数约为13% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com