
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g) ZnO(s) ΔH=-332 kJ/mol
ZnO(s) ΔH=-332 kJ/mol
ZnO(s) + H2SO4(aq)  ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
H2(g) +1/2 O2(g) H2O(l) ΔH =-286kJ/mol
H2O(l) ΔH =-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热ΔH = kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
【答案】(1)Zn +2H+ Zn2+ + H2↑;(2)浓H2SO4具有强氧化性,不能生成氢气。
Zn2+ + H2↑;(2)浓H2SO4具有强氧化性,不能生成氢气。
(3)-158;(4)①快;形成原电池反应速度快;②断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+);③断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能。前者使溶液的温度升得更高,故反应速率更快。
【解析】本题考查了盖斯定律的应用、原电池原理的应用、影响速率的因素等,题目难度中等,注意形成原电池能加快反应速率。(1)Zn与稀硫酸反应生成硫酸锌和氢气,其反应的离子方程式为:Zn+2H+ Zn2++H2↑;(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫,所以制H2时,用稀硫酸而不用浓硫酸;(3)①Zn(s)+O2(g)
Zn2++H2↑;(2)浓硫酸具有强氧化性,与Zn反应生成二氧化硫,所以制H2时,用稀硫酸而不用浓硫酸;(3)①Zn(s)+O2(g) ZnO(s)△H=-332kJ/mol;②ZnO(s)+H2SO4(aq)
ZnO(s)△H=-332kJ/mol;②ZnO(s)+H2SO4(aq) ZnSO4(aq)+H2O(l)△H=-112kJ/mol③H2(g)+O2(g)
ZnSO4(aq)+H2O(l)△H=-112kJ/mol③H2(g)+O2(g) H2O(l)△H=-286kJ/mol,根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq)
H2O(l)△H=-286kJ/mol,根据盖斯定律:①+②-③得Zn(s)+H2SO4(aq) ZnSO4(aq)+H2↑,则△H=(-332kJ/mol)+(-112kJ/mol)-(-286kJ/mol)=-158kJ/mol;(3)①形成原电池能加快反应速率,所以在反应初期,闭合K时比断开K时的反应速率快;②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快。
ZnSO4(aq)+H2↑,则△H=(-332kJ/mol)+(-112kJ/mol)-(-286kJ/mol)=-158kJ/mol;(3)①形成原电池能加快反应速率,所以在反应初期,闭合K时比断开K时的反应速率快;②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;③断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,则随着反应进行,断开K时,放出的热量使溶液的温度升高,温度越高反应速率越快。


科目:高中化学 来源: 题型:
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
|
| A. | 氨水的电离作用大于氯化铵的水解作用 |
|
| B. | 氯化铵的水解作用大于氨水的电离作用 |
|
| C. | 氨水的存在抑制了氯化铵的水解 |
|
| D. | 氯化铵的存在抑制了氨水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于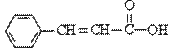 的下列说法中正确的是
的下列说法中正确的是
A.分子式为C9H9O2
B.含有三种官能团
C.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色
D.可以发生取代反应和加成反应,但不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
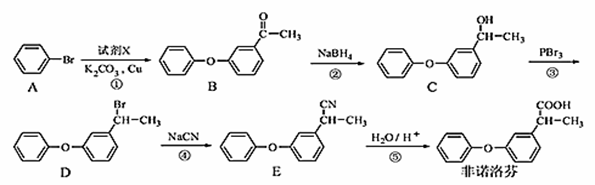
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)化合物A的分子式为 。
(3)反应④的反应类型是 。
(4)化合物D与NaOH醇溶液反应的方程式 。
(5)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中含有两个苯环,且分子中有6种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(6)利用类似上述非诺洛芬的合成方法,写出以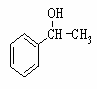 为原料制备
为原料制备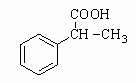 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心。下列关于SF6的推测中,正确的是
A.SF6在氧气中燃烧可生成SO2
B.SF6晶体是原子晶体
C.SF6是非极性分子
D.SF6中各原子的最外电子层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生的实验报告所列出的下列数据中合理的是( )
|
| A. | 用10mL量筒量取7.13mL稀盐酸 |
|
| B. | 用托盘天平称量25.20g NaCl |
|
| C. | 用广泛pH试纸测得某溶液的pH为2.3 |
|
| D. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
|
| A. | 相同浓度的两溶液中c(H+)相同 |
|
| B. | 100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
|
| C. | pH=3的两溶液稀释100倍,pH都为5 |
|
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学的知识回答:
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 .
(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因,用离子方程式表示 .
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加 入 溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物CH2=CH﹣CH2﹣CH2﹣OH可能发生的反应有
①取代 ②加成 ③消去 ④使溴的四氯化碳溶液褪色 ⑤聚合 ⑥与氢氧化钠溶液反应,其中能发生的有( )
|
| A. | 全部 | B. | 除④外 | C. | 除③外 | D. | 除⑥外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com