
甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。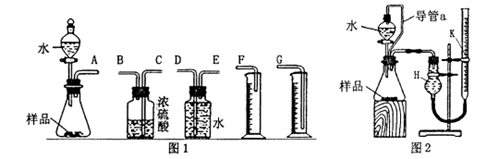
(1)甲组同学拟选用图1实验装置完成实验:
①写出实验中所发生反应的化学方程式_______;
②该组同学必须选用的装置的连接顺序是:
A接( ),( )接( ),( )接( )(填接口字母,可不填满);
(2) 乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气, 也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用是:_______。
②实验结束后,在读取量气管k中液面读数时,你认为最合理的顺序是_______(用A、 B、C字母表示)
A. 视线与量气管k中凹液面的最低点相平
B. 等待实验装置冷却
C. 上下移动量气管k,使k中液面与H中的液面相平
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标 况)。则样品的纯度为 _______ (含w、V的表达式)。
(3)图2的装置也可测定一定质量铝镁合金(不含其它元素)样品中铝的质量分数。分液漏斗中加入的试剂是_______,能否加入氢氧化钠溶液 _______ (填“能”或“不能”),说明理由______________。
(11分)(1)① Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑(2分);
②EDG (1分)
(2)①可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差(2分)
②BCA (1分)
③Na2O2%=195×(V1-V2)/28w×100%(2分);
(3)H2SO4(答案合理均可) (1分),不能(1分) ,
若盛装碱液将会使分液漏斗旋塞粘住,造成分液漏斗损坏 (1分)
解析试题分析:(1)① Na2O2、Na2O都能与水反应,方程式为Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑。
②O2是不溶于水的气体,通过排水法测得生成气体的体积,故A接E,E接D,D接G。
(2) ①因为反应过程中有气体生成,要保持压强里外相等,故装置中导管a的作用是可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差。
②反应是放热反应,首先要等到实验装置冷却后在操作,待装置冷却后,就要上下移动量气管k,使k中液面与H中的液面相平,读数时视线与量气管k中凹液面的最低点相平,故最合理的顺序是BCA。
③反应产生的气体为O2,反应为2Na2O2+2H2O=4NaOH+O2↑。通过化学方程式的计算得样品的纯度为Na2O2%=195×(V1-V2)/28w×100%。
(3) 铝镁合金中,可以选择H2SO4试剂,但不能用氢氧化钠溶液,因为若盛装碱液将会使分液漏斗旋塞粘住,造成分液漏斗损坏。
考点:实验探究物质的组成成分以及含量 常用气体的收集方法 氧气的检验和验满 质量守恒定律及其应用
点评:本题主要考查学生金属钠的氧化物和过氧化物的性质以及用排水量气法测定气体的体积的方法,难度中等。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新疆乌鲁木齐地区高三第一次诊断性测验化学试卷(解析版) 题型:实验题
甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。
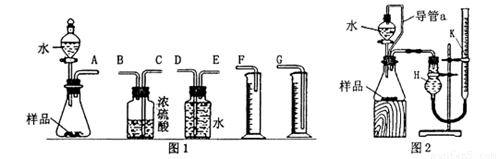
(1)甲组同学拟选用图1实验装置完成实验:
①写出实验中所发生反应的化学方程式_______;
②该组同学必须选用的装置的连接顺序是:
A接( ),( )接( ),( )接( )(填接口字母,可不填满);
(2) 乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气, 也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用是:_______。
②实验结束后,在读取量气管k中液面读数时,你认为最合理的顺序是_______(用A、 B、C字母表示)
A. 视线与量气管k中凹液面的最低点相平
B. 等待实验装置冷却
C. 上下移动量气管k,使k中液面与H中的液面相平
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标 况)。则样品的纯度为 _______ (含w、V的表达式)。
(3)图2的装置也可测定一定质量铝镁合金(不含其它元素)样品中铝的质量分数。分液漏斗中加入的试剂是_______,能否加入氢氧化钠溶液 _______ (填“能”或“不能”),说明理由______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三9月月考理科综合试题(化学部分) 题型:实验题
(15分)有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法。
(1)甲组同学拟选用图27题-l的实验装置完成实验:

①铝硅合金与足量稀硫酸的反应的离子方程式__________________________________。
②该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,过一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因_________________________________________
____________________________________________________________________________。
④实验结束时,测量实验中生成氢气的体积时应注意:a.待实验装置
冷却到(约20℃,1atm)后,上下移动量筒,使其中液面与广口瓶中
液面相平,b.______________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图27题-2所示的实验装置。

装置中导管a的作用是
____________________________________________________
_____________________________________________________。
②实验中准确测得4个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL。则通常状况时气体摩尔体积Vm=_______L·moL-1。
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江哈九中高一上学期期中考试化学试卷 题型:实验题
某中学有甲、乙两个探究性学习小组,他们拟用小颗粒的铝铜合金与足量的稀硫酸反应测定通常状况(约20℃、1.01×105Pa)下的气体摩尔体积(Vm)。

(一)甲组同学拟设计如图1所示的装置来完成实验。
(1)写出装置I中发生反应的离子方程式: 。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻旋开其活塞,一会儿后发现稀硫酸不能顺利滴入锥形瓶中。请帮助他们分析其原因: 。
(3)实验结束时,生成氢气的体积近似等于: 。
(4)锥形瓶中残存的氢气对实验结果是否有影响: (填“有”、“没有”、或“不能判断”),简述理由: 。
(二)乙组同学仔细分析了甲组同学的实验装置后以为,稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶中的空气排出,使所测氢气的体积偏大;实验结束后,连接广口瓶
和量筒的导管中有少量水存在,使所测氢气的体积偏小。于是他们设计了如图2所示的实验装置。
(1)装置中导管a的作用是: 。
(2)实验中准确测定出4个数据,如下表:
|
|
实验前 |
实验后 |
|
铝铜合金质量(g) |
m1 |
m2 |
|
量液管(C)体积(mL) |
V1 |
V2 |
利用上述数据计算通常状况下的气体摩尔体积:Vm= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com