

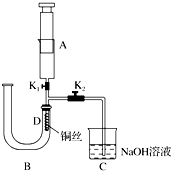
分析 实验一:(1)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜和二氧化硫、水;根据n=$\frac{V}{{V}_{m}}$计算出生成二氧化硫的物质的量,再结合反应方程式计算出转移的电子的物质的量;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
实验二:(1)若U形管右端稀硝酸接触胶塞时,U形管中空气已被排净;
(2)稀硝酸与铜反应生成硝酸铜和NO和水,据此写出反应的离子方程式;
(3)NO为无色,用到空气后一氧化氮与氧气反应生成红棕色的二氧化氮,据此可检验NO;
(4)实验结束后关闭止水夹K1,打开止水夹K2,在重力作用下,U型管右端的红棕色混合气体被酸液压入NaOH溶液中吸收.
解答 解:(1)浓硫酸具有强氧化性,能和铜反应,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;标况下112mL二氧化硫的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol,生成0.005mol二氧化硫转移的电子为:0.005mol×(6-4)=0.01mol,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;0.01mol;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色,
故答案为:蘸有品红溶液的滤纸褪色;恢复红色;
实验二:(1)当U形管右端稀硝酸接触胶塞时,可以确定U形管中空气已被赶尽,
故答案为:U形管右端稀硝酸接触胶塞;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)B中硝酸和铜反应生成NO,易与氧气反应,则将A中空气压入B中,会有红棕色气体生成,如果观察到红棕色,则说明生成NO而不是氢气,
故答案为:将A中空气压入B中,有红棕色气体生成;
(4)实验后消除环境污染的操作方法为:实验现象观察完毕,关闭止水夹K1,打开止水夹K2,在重力作用下,U型管右端的红棕色混合气体被酸液压入NaOH溶液中吸收,消除了环境污染,
故答案为:实验现象观察完毕,关闭止水夹K1,打开止水夹K2,在重力作用下,U型管右端的红棕色混合气体被酸液压入NaOH溶液中吸收,消除了环境污染.
点评 本题考查了性质实验方案的设计,题目难度中等,熟练掌握浓硫酸、浓硝酸的化学性质为解答关键,明确性质实验方案的设计与评价原则,试题涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出,两份蛋白质均发生变性 | |
| B. | 只用溴水就可以将苯、四氯化碳、酒精、己烯、苯酚这五种物质区别开来 | |
| C. | 由于纤维素易发生水解反应,所以用纤维素织成的衣物不可在碱性溶液中洗涤 | |
| D. | 丙氨酸 分子中含有1个手性碳原子 分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).
;B元素在周期表中的位置是第二周期ⅥA族.A比B的非金属性弱(填“强”或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片与硫酸制取氢气时,硫酸浓度越大制取氢气的速率一定越快 | |
| B. | 等质量的锌粉和锌片与等物质的量浓度的盐酸反应,反应速率相等 | |
| C. | 升高温度对于放热反应可以加快反应速率,对于吸热反应可以减小反应速率 | |
| D. | 可逆反应中加入催化剂可以同时加快正逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化过程是原子重新组合的过程 | |
| B. | 一个化学反应中,当反应物能量大于生成物能量时,反应放热,△H为“-” | |
| C. | 化学反应中能量变化的多少与反应物的量有关 | |
| D. | 任何条件下的焓变都等于反应热,二者没有区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: | |
| C. | 质量数为137的钡原子:${\;}_{137}^{56}$Ba | |
| D. | 硫酸的电离方程式:H2SO4=2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸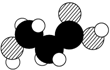 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 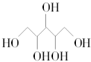 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com