
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. 2b=c D. a=b
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
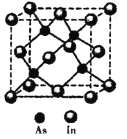
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元紧对应原子的M层电子排布式为________________。
(2)如下图2所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为__________(填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________。
(4)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的熔点比SiO2晶体______(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。

(5)如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;

则:C20分子共有____个正五边形,共有______条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为______(填“有”或“无”)色离子,依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中ΔH表示可燃物燃烧热的是
A. CO(g)+1/2O2(g)===CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有一种变化的反应类型与其他三种变化不同的是( )
A. CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C. 2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D. CH3CH2OH + HBr=CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 脱氧曲酸的分子式为C6H4O3
B. 脱氧曲酸能发生加成反应和酯化反应
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 与脱氧曲酸互为同分异构体的芳香族化合物有3种(不考虑—O—O—键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A. ②⑤⑦⑧ B. ①④⑤⑦⑧ C. ④⑤⑦⑧ D. ②③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求进行计算,直接写出计算结果:
(1)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(2)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为__________;R元素名称是__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)将10 mL 1.00 mol/L Na2CO3溶液与10 mL 1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为__________,则混和溶液中Cl-的物质的量浓度为__________(忽略混合前后溶液体积的变化)。
(6)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(7)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(8)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com