
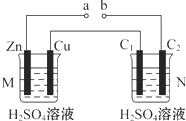
| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
分析 如果a、b连接时,左边装置是原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,C1是阳极,电极反应式为OH--4e-=2H2O+O2↑,C2是阴极,电极反应式为2H++2e-=H2↑;
如果a、b不连接时,左边装置不能构成原电池,只有锌和稀硫酸发生置换反应,据此分析解答.
解答 解:A.a、b连接,M是原电池,铜电极上氢离子放电生成氢气,导致溶液酸性减弱,N中电解水,导致硫酸浓度增大,所以工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小,故A正确;
B.a、b连接,M是原电池,所以装置M中若有0.1molSO42-移到Zn电极,而不是铜极,故B错误;
C.a、b未连接时,装置N中不发生反应,所以装置N中C1电极上无气体析出,故C错误;
D.a、b连接时,装置M中发生原电池反应,Cu作正极,有气体生成,a、b不连接时,锌和氢离子直接反应,接触面上析出气体,所以观察到的实验现象不相同,故D错误;
故选A.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,知道电解质溶液中阴阳离子移动方向,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:c>b>a | |
| B. | a与c形成化合物的溶液有毒,要密封保存于玻璃瓶中 | |
| C. | a2b2与d的一种较高价态离子的盐溶液混合时会产生大量的b2 | |
| D. | d高价离子在溶液中与c的低价离子因发生氧化还原反应而不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
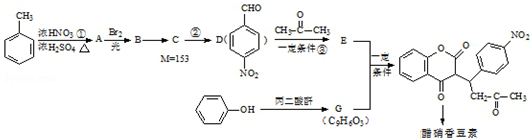
 +H2O
+H2O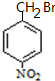 G
G
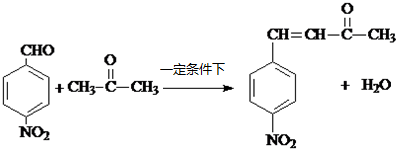
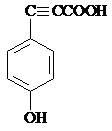 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VSEPR模型就是分子的空间构型 | |
| B. | 在共价化合物分子中一定存在σ键 | |
| C. | Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 | |
| D. | 共价键键长越短,键能一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com