
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MnO2![]() Cl2
Cl2![]() SiCl4
SiCl4
B. Ca(ClO)2![]() HClO
HClO![]() HCl
HCl
C. 浓H2SO4![]() SO2
SO2![]() BaSO4
BaSO4
D. SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
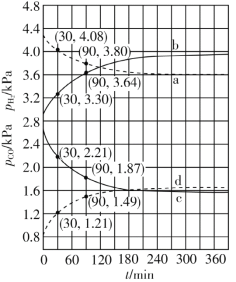
计算曲线a的反应在30~90 min内的平均速率![]() (a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
(a)=___________kPa·min1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂粉精是常用的消毒剂。
(1)工业上制取漂粉精的化学方程式为______________________,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空气中易失效的主要原因是___________、_______________(用化学方程式表示)
(3)浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂粉精和浓盐酸反应制得的氯气中,可能含有的杂质气体是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
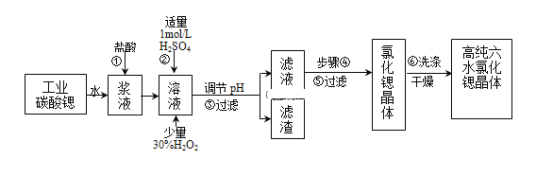
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①需要加快反应速率,措施有充分搅拌和______(写一种).碳酸锶与盐酸反应的离子方程式______.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至______;宜用的试剂为______.
A.1.5B.3.7C.9.7D.氨水E.氢氧化锶粉末F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是______(填化学式).
(4)工业上用热风吹干六水氯化锶,适宜的温度是______
A.50~60℃B.80~100℃C.100℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
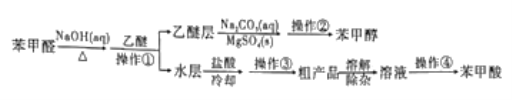
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
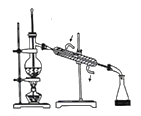
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A. 加压,平衡右移,化学平衡常数增大
B. 此时,B的平衡转化率是40%
C. 该反应的化学平衡常数表达式是K=![]()
D. 增加C,B的平衡转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题:

(1)甲烷燃料电池负极的电极反应式为_____________________。
(2)乙装置中阳离子通过X膜向________ 极(填“Fe”或“C”)移动,写出乙装置中的石墨电极上的电极方程式____________________________________。
(3)若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液________(填“增加”或“减少”)______g,丙装置中CuSO4浓度__________(填“增加”、“减少” 或“不变”);若将乙装置两侧溶液混合,常温下加水稀释至体积为4 L,则此时溶液液的pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com