
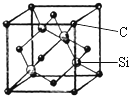
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:分析 (1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,硒显负价,硒与硅的电负性相对大小为Se>Si;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;根据价层电子对互斥理论计算杂化类型;
(4)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;用均摊法计算,用公式ρ=$\frac{m}{V}$求算密度.
解答 解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O,
故答案为:1s22s22p63s23p63d104s1;CuO中铜的价层电子排布为3d9,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si,
故答案为:V形,正四面体;>;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;二氧化硒分子中价层电子对=2×$\frac{1}{2}$(6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形,
故答案为:分子晶体;sp2;
(4)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键,
故答案为:sp3;配位;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=$\frac{m}{V}$=$\frac{4×40g/mol}{(a×1{0}^{-10}cm)^{3}×6.02×1{0}^{23}/mol}$g•cm3,
故答案为:原子晶体;12;$\frac{4×40g/mol}{(a×1{0}^{-10}cm)^{3}×6.02×1{0}^{23}/mol}$.
点评 本题考查了晶胞计算、原子杂化判断、原子核外电子排布式的书写等相关知识,难度较大,综合性强,学生很容易失分.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丙>乙>甲>丁 | |
| B. | 气态氢化物的熔点:丙>甲 | |
| C. | 乙元素在自然界中形成的化合物种类最多 | |
| D. | 乙和甲、丙、丁都一定能形成两种或两种以上的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和CO2中只含有共价键 | |
| B. | CCl4和NH3的立体构型都是正四面体 | |
| C. | BF3中各原子均达到8电子的稳定结构 | |
| D. | 甲烷是对称的平面形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C和C60属于同一种元素,互为同素异形体 | |
| B. | 16O和18O是不同的核素,互为同位素 | |
| C. | 37Cl和35Cl可以通过化学变化实现相互转化 | |
| D. | H2O和H2O2由同种元素组成,二者互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com