
����Ŀ�����ij�¶���0.5mol��L-1 HNO2�������ᣩ��Һ��pHԼΪ2��
��1��д��HNO2�ĵ��뷽��ʽ___��
��2������Һ��ˮϡ����10����c(NO2-)___������������������С����������������n(H+)___������������������С����������������pH���䷶Χ��___��
A.1��2 B.2��3 C.3��4 D.4��5
��3���ֱ�ȡͬŨ��ͬ����������������ᣬ��ͬ���IJ���������NaOH��Һ��Ӧ����÷�Ӧ��Һ������¶�����Ҫ���������ᣬ˵�����ܵ�ԭ��___��
��4��0.1mol��L-1 NaNO2��ҺpH___7��������������������������������Һ�к���___�ַ��ӣ���Һ��c(Na+)___c(NO2-)���������������������������������д�ʩ�������Һ��c(OH-)����___��
A.�ʵ������¶� B.����ѹǿ C.��ˮ D.����NH4Cl���� E.����Na2CO3����
���𰸡�HNO2![]() H++NO2- ��С ���� B ����������� �� 2 �� AE
H++NO2- ��С ���� B ����������� �� 2 �� AE
��������
��1��0.5mol��L-1 HNO2�������ᣩ��Һ��pHԼΪ2��c(H+)=0.01mol/L���������HNO2ֻ�������ֵ��룬����H+��NO2-��HNO2Ϊ���
��2������Һ��ˮϡ����10����HNO2����̶�����n(NO2-)����n(H+)����������Һ�������ռ������λ������c(NO2-)��С������ƽ�ⲻ�ƶ���pH=3��ƽ���ƶ���c(H+)����pH��С������ԭpH�Ӷ�ȷ�����䷶Χ��
��3���ֱ�ȡͬŨ��ͬ����������������ᣬ��ͬ���IJ���������NaOH��Һ��Ӧ����÷�Ӧ��Һ������¶�����Ҫ���������ᣬ˵��HNO2�������ȣ�
��4����ΪHNO2Ϊ���ᣬ��NaNO2����Һ�з���ˮ���ʹ��Һ�Լ��ԣ���Һ�к���ˮ���Ӻ���������ӣ���ˮ���c(NO2-)��С����Һ��c(Na+)����c(NO2-)��
A.�ʵ������¶ȣ��ܴٽ����ȵ�NO2-ˮ�ⷴӦ�����ƶ���c(OH-)����
B.����ѹǿ��������Ӧ��û��������뷴Ӧ����c(OH-)������Ӱ�죻
C.��ˮ����Һϡ�ͣ�NaNO2ˮ��̶�����n(OH-)����c(OH-)��С��
D.����NH4Cl���壬NH4+��NO2-ˮ�����ɵ�OH-��ϣ��Ӷ��ٽ�NO2-ˮ�ⷴӦ�Ľ��У���c(OH-)��С��
E. CO32-��ˮ��������NO2-ǿ������Na2CO3���壬c(OH-)����
��1��0.5mol��L-1 HNO2�������ᣩ��Һ��pHԼΪ2��c(H+)=0.01mol/L���������HNO2ֻ�������ֵ��룬����H+��NO2-��HNO2Ϊ���ᣬ��HNO2�ĵ��뷽��ʽHNO2![]() H++NO2-��
H++NO2-��
��2������Һ��ˮϡ����10����HNO2����̶�����n(NO2-)����n(H+)����������Һ�������ռ������λ������c(NO2-)��С������ƽ�ⲻ�ƶ���pH=3��ƽ���ƶ���c(H+)����pH��С������ԭpH�Ӷ�ȷ�����䷶Χ��2~3֮�䣻
��3���ֱ�ȡͬŨ��ͬ����������������ᣬ��ͬ���IJ���������NaOH��Һ��Ӧ����÷�Ӧ��Һ������¶�����Ҫ���������ᣬ˵��HNO2�������ȣ�
��4����ΪHNO2Ϊ���ᣬ��NaNO2����Һ�з���ˮ���ʹ��Һ�Լ��ԣ�pH>7����Һ�к���ˮ���Ӻ���������ӹ�2�ַ��ӣ���ˮ���c(NO2-)��С����Һ��c(Na+)����c(NO2-)��
A.�ʵ������¶ȣ��ܴٽ����ȵ�NO2-ˮ�ⷴӦ�����ƶ���c(OH-)����A�������⣻
B.����ѹǿ��������Ӧ��û��������뷴Ӧ����c(OH-)������Ӱ�죬B�������⣻
C.��ˮ����Һϡ�ͣ�NaNO2ˮ��̶�����n(OH-)����c(OH-)��С��C�������⣻
D.����NH4Cl���壬NH4+��NO2-ˮ�����ɵ�OH-��ϣ��Ӷ��ٽ�NO2-ˮ�ⷴӦ�Ľ��У���c(OH-)��С��D�������⣻
E. CO32-��ˮ��������NO2-ǿ������Na2CO3���壬c(OH-)����E�������⣻
����AE��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�������㶨���ܱ������з�����Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H=-QkJ��mol-1������˵����ȷ���ǣ� ��
2NH3(g) ��H=-QkJ��mol-1������˵����ȷ���ǣ� ��
A.�ﵽƽ��ʱ��Ӧ�ų����������ܴﵽQkJ
B.�����¶ȣ��淴Ӧ���ʼ�С
C.�����������ܶȲ��ٷ����仯ʱ��˵����Ӧ�ﵽƽ��״̬
D.�ﵽƽ��ʱ��v��(N2)=3v��(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij�л������ʽΪC2H6O���û�����ĺ˴Ź�����ͼ��ͼ��ʾ����д����ṹ��ʽ___��

��2���л���CH3��CH2��CH2��OH��1-���������˴Ź���������___�������壬��ǿ�ȱ�Ϊ___��
��3������ͬϵ��C9H12�ĺ˴Ź�������ͼ����2�������壬�ҷ����֮��Ϊ1��3����ṹ��ʽ___��
��4����֪��1��3-����ϩ��һ���ϩ���ܷ��������˫���Ļ��������1��4-�ӳɷ�Ӧ�����ɻ�״��������෴Ӧ��Ϊ˫ϩ�ϳɣ����磺

�����к�����д���ʵ��ķ�Ӧ���������Ľṹ��ʽ��������з�Ӧ�Ļ�ѧ����ʽ��
��![]() +
+![]() ��___
��___
��___+___��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ A2+B2 = 2AB �������仯��ͼ��ʾ��������˵����ȷ���ǣ� ��

A.�÷�Ӧ�����ȷ�Ӧ
B.����1molA-A����1molB-B���ܷų�x kJ ������
C.2molAB����������1mol A2��1molB2�͵�������
D.����2molA-B����Ҫ����y kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ�ԭ��������������A��Eͬ���壬AԪ�ص�ԭ�Ӱ뾶��С��BԪ��ԭ�ӵ��������������ڲ��������2����CԪ��ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1��A��B��C��Eÿ��Ԫ�ض�����DԪ��������ֻ��������ϵij�������� �ش��������⣺
��1��д�����и�Ԫ�ط��ţ�C___________ E____________
��2��A��C�γɵ��������ĵ���ʽΪ___________��A��D��ԭ����1:1�γɵĻ�����ĽṹʽΪ___________��
��3����֪�� BA3DA(g)+A2D(g)=BD2(g)+3A2(g) ��H= +49��0kJ��mol
BA3DA(g)+1��2D2(g)=BD2(g)+2A2(g) ��H = һ192��9kJ��mol
��д������̬BA3DA��ȫȼ��������̬A2D���Ȼ�ѧ����ʽ(���Ƴ���Ԫ�ط���д����ͬ)
______________________________________________________________��
���ø�ȼ�շ�Ӧ��Ƴɵ�ȼ�ϵ�����õ��ƹ㣬��д����ȼ�ϵ�ظ����缫��Ӧʽ(�������ҺΪKOH)��___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪п���仯����������������仯�������ơ���ͼ������Ϊ��Һ��pH��������ΪZn2+��[Zn(OH)4 ]2-�����ʵ���Ũ�ȵĶ�����25��ʱ������˵���в���ȷ����

A. ��ZnCl2��Һ�м����������������Һ����Ӧ�����ӷ���ʽΪZn2++4OH-=[Zn(OH)4]2-
B. ��Ҫ��ij��Һ����ȫ����Zn2+��ͨ�����Ե��ظ���Һ��pH��8.0��12.0֮��
C. pH=8.0��pH=12.0�����ַ�Һ�У�Zn2+Ũ��֮��Ϊ108
D. ���¶�ʱ��Zn(OH)2���ܶȻ�����(Ksp)Ϊ1��l0-10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ժ�CO2������Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ.����˵������ȷ����
FeO(s)��CO(g)��һ���¶��£���ij�ܱ������м����������۲�����һ������CO2���壬��Ӧ������CO2�����CO�����Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ.����˵������ȷ����

A. a��Ϊƽ��״̬
B. b���c��Ļ�ѧƽ�ⳣ��K��ͬ
C. �÷�Ӧ�Ļ�ѧƽ�ⳣ����ʾΪK =[CO]��[FeO]/[CO2]��[Fe]
D. ���¶����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ��K������÷�Ӧ�� ��H �� 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�����ʺ��ȶ�����������������Ҫ�����塣
(1)��֪Na2S2O3��H2SO4=Na2SO4��S����SO2��H2O����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬���ʵ������(��ȡ��Һ�����Ϊ2 mL)��
ʵ���� | �¶�/�� | c(Na2S2O3)/mol��L��1 | c(H2SO4)/mol��L��1 |
�� | 25 | 0.1 | 0.1 |
�� | 25 | 0.2 | 0.1 |
�� | 50 | 0.2 | 0.1 |
������ʵ������Һ���ȱ���ǵ���______����ʵ���ţ���ͬ����
��Ϊ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��______��______��
(2)ij�¶��£���1 L�ܱ������У�������Ӧ��2X(g)��Y(g)![]() 2Z(g)��X�����ʵ�����ʱ��ı仯���±���
2Z(g)��X�����ʵ�����ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
X�����ʵ���/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
����X��Ũ�ȱ仯��ʾ0��2 s��ƽ����ѧ��Ӧ����Ϊ______mol/(L��s)��
����3 s�Ժ�X��Ũ�Ȳ��ٸı䣬��Ӧ�ﵽ��______״̬��
����˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����______(�����)��
A��v��(X)=v��(X)
B����λʱ������2 mol X����ͬʱ��1 mol Y����
C��X��Y��Z�ķ�����֮��Ϊ2��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʯī��������ͭ������������� 200mL������ Cu2+��Fe3+���ӵ�������Һ���������ɹ�����ת�Ƶ��ӵĹ�ϵ�� ������˵����ȷ���ǣ� ��
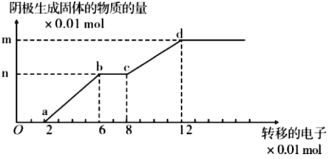
A.Oa ��bc �����������������
B.bc �εĵ缫��ӦΪ��Fe3++e-=Fe2+
C.ԭ��Һ PH ֵԼΪ 1
D.����Һ�� Cu2+��Fe3+���ӵ�Ũ��֮��Ϊ 1:2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com