
【题目】已知酸性: ![]() >H2CO3>
>H2CO3> ![]() ,将
,将 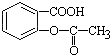 转变为
转变为 ![]() 的方法是( )
的方法是( )
A.与足量的NaOH溶液共热,再通入CO2
B.与稀H2SO4共热后,加入足量的NaOH溶液
C.加热溶液,通入足量的CO2
D.与稀H2SO4共热后,加入足量的NaHCO3溶液
【答案】AD
【解析】解:A.与足量的NaOH溶液共热,生成羧酸钠和酚钠结构,因 ![]() >H2CO3>
>H2CO3> ![]() ,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;
,则再通入足量的CO2生成邻羟基苯甲酸钠,故A正确;
B.与稀H2SO4共热后,生成邻羟基苯甲酸,再加入足量的NaOH溶液,生成  ,故B错误;
,故B错误;
C.加热溶液,通入足量的CO2 , 不发生反应,故C错误;
D.与稀H2SO4共热后,生成邻羟基苯甲酸,加入足量的NaHCO3溶液,只有﹣COOH反应生成羧酸钠和酚结构,生成 ![]() ,故D正确;
,故D正确;
故选AD.
【考点精析】根据题目的已知条件,利用有机物的结构和性质的相关知识可以得到问题的答案,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 . 若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是(用Q1、Q2、Q3表示).
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是; 若实验中不加盖泡沫塑料板,则求得的中和热数值(填偏大、偏小、无影响) 
(3)实验室用50mL 0.50molL﹣1盐酸、50mL 0.55molL﹣1NaOH溶液利用如图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 又知中和后生成溶液的比热容c=4.18J/(g℃).为了计算中和热,实验时还需测量的数据有(填序号) .
A.反应前盐酸的温度
B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.4 |
2 | 20.2 | 20.4 | 23.6 |
3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热△H为 . (保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.76g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是( ) 
A.V=224
B.样品中Fe的质量为2.14 g
C.未氧化前Fe元素的质量分数约为41.2%
D.样品中CuO的质量为3.52 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们质量总和不到体里的千万分之,但是对人的健康却起着重要作用,下列各组元素全部是微量元素的是( )
A. K、CL、S、OB. Mn、Fe、Zn、Cu
C. N、H、P、CD. K、Ca、C、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,盛有催化剂的体积一定的密闭容器中,通入一定量的SO3气体,发生分解反应2SO32SO2+O2 , 并达到平衡状态,测得SO3的分解率为75%.下列说法正确的是( )
A.平衡后的压强为起始压强的1.25倍
B.平衡时混合气体的平均相对分子质量为64
C.混合气体的密度自始至终保持不变
D.取和SO3等质量的SO2和O2的混合气体,从逆反应开始并达到平衡,在相同条件下各物质的浓度与原来的平衡浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Na2CO33H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
Ⅰ.实验制备
实验原理:2Na2CO3+3H2O2═2Na2CO33H2O2
实验步骤:取3.5g Na2CO3溶于10mL H2O,加入0.1g稳定剂,用磁力搅拌器搅拌完全溶解后,将6.0mL 30%H2O2在15min内缓慢加入到三颈烧瓶中,实验装置如图.反应1小时后,加入1g氯化钠后,静置结晶,然后抽滤,干燥一周后,称重.
(1)装置中球形冷凝管的作用是 . 使用冷水浴的作用是 .
(2)加入适量NaCl固体的原因是 .
(3)2Na2CO33H2O2极易分解,其反应方程式可表示为 .
(4)Ⅱ.活性氧含量测定
准确称取试样0.2000g,置于250mL锥形瓶中,加100mL浓度为6%的硫酸溶液,用0.0200mol/LKMnO4标准溶液滴定,记录KMnO4标准溶液消耗的体积为32.70mL.活性氧含量计算公式:Q%=(40cV/m)×100%[c:KMnO4标准溶液浓度(mol/L);V:消耗的KMnO4标准溶液体积(L);m:试样质量(g)]滴定终点的判断依据为 . 活性氧含量为 .
(5)Ⅲ.产品纯度的测定
为了测定产品中2Na2CO33H2O2的质量分数,设计了几种方案,涉及不同的反应原理.
方案一 将试样与MnO2混合均匀,向混合物中滴加水,测生成气体的体积,进而进行计算.
方案二 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣ , 处理该废水常用的流程如图1所示:
Na2S2O3在此过程中表现性.若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为价,反应的离子方程式为 .
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车.其反应原理如下,请配平该反应方程式:CrO3+CH3CH2OH+H2SO4﹣CH3CHO+Cr2(SO4)3+H2O
(3)已知存在平衡:2CrO42﹣+2H+Cr2O72﹣+H2O.向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为(任意写出其中一种即可).此时溶液中c(Pb2+):c(Ba2+)= .
已知Ksp(BaCrO4)=1.25×10﹣10;Ksp(PbCrO4)=2.75×10﹣13
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7 , 制备装置如图2所示(阳离子交换膜只允许阳离子透过).通电后阳极的电极反应式为 . 请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式.
①甲苯→TNT
②乙醛与银氨溶液反应的离子方程式
③2﹣溴丙烷→丙烯
④乙烯→乙醇 .
⑤苯酚钠溶液中通入二氧化碳气体的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1: 
(1)写出“碱浸”反应的离子方程式;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42﹣ . 当BaMoO4开始沉淀时,SO42﹣的去除率是;[已知:碱浸液中c(MoO42﹣)=0.40molL﹣1 , c(SO42﹣)=0.04molL﹣1 , Ksp(BaSO4)=1.1×10﹣10、Ksp(BaMoO4)=4.0×10﹣8 , 加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4﹣Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2 . NaNO2的作用是;
③若缓释剂钼酸钠﹣月桂酸肌氨酸总浓度为300mgL﹣1 , 则缓蚀效果最好时钼酸钠的物质的量浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com